短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数之和为10,则A与
C在周期表中位置上下相邻,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是( )
A.A与C可形成共价化合物
B.A的氢化物的稳定性大于C的氢化物的稳定性
C.原子半径A<B<C
D.B的氧化物的熔点比A的氧化物熔点低
下列实验操作中正确的是
| A.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
| B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 |
| D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 |
.下列实验操作中,不能用于物质分离的是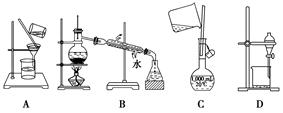
高温下,某反应达平衡,平衡常数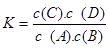 。恒容时,温度升高,B的浓度减小。下列说法正确的是
。恒容时,温度升高,B的浓度减小。下列说法正确的是
①该反应的焓变为正值②恒温恒容下,增大压强,B浓度一定减小
③升高温度,逆反应速率减小④该反应化学方程式为C(g) +D(g)  A(g)+B(g)
A(g)+B(g)
⑤增加A的量,平衡向正反应方向移动⑥加入催化剂,B的转化率提高
| A.①③⑥ | B.①⑤ | C.①④⑤ | D.②⑤ |
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g);ΔH=" +Q" kJ·mol-1mol(Q>0)
Si(s)+4HCl(g);ΔH=" +Q" kJ·mol-1mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
| D.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min) |
250 ℃和1.01×105 Pa时,反应2XY3(g) ===X2(g)+3Y2(g) ΔH=+56.76 kJ/mol,自发进行的原因是
| A.熵增大效应大于能量效应 | B.是放热反应 |
| C.是熵减少的反应 | D.是吸热反应 |