如图所示的装置中铁棒上析出铜,而铁的质量不变,符合要求的原电池是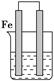
| A.铁棒作负极,铜棒作正极,电解质溶液是CuSO4溶液 |
| B.镁棒作负极,铁棒作正极,电解质溶液是CuSO4溶液 |
| C.镁棒作负极,铁棒作正极,电解质溶液是FeCl3溶液 |
| D.铁棒作负极,铜棒作正极,电解质溶液是H2SO4溶液 |
下列溶液中微粒的物质的量浓度关系正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液:c(H+)= c(OH-)= c(NH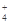 )=c(Cl-) )=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| D.常温下,pH=2的CH3COOH与pH=12的NaOH等体积混合:c (CH3COO-)+ c(H+)>c(Na+)+c(OH-) |
酚酞,别名非诺夫他林,是制药工业原料,其结构如图所示,有关酚酞说法不正确的是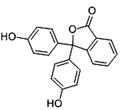
| A.分子式为C20H14O4 |
| B.可以发生取代反应、加成反应、氧化反应 |
| C.含有的官能团有羟基、酯基 |
| D.1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol |
下列解释实验事实的化学方程式或离子方程式正确的是
A.用pH试纸检测,氨水溶液呈碱性: NH3·H2O  NH4+ + OH— NH4+ + OH— |
B.100℃时,测得纯水中c(H+)·c(OH—) =1×10—12:H2O(l)  H+(aq) + OH—(aq) H+(aq) + OH—(aq)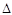 H<0 H<0 |
C.FeCl3溶液中通入适量SO2,溶液黄色褪去:2Fe3++SO2 +2H2O  2Fe2+ + SO42—+ 4H+ 2Fe2+ + SO42—+ 4H+ |
| D.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O →2C6H5OH+Na2CO3 |
下表中各组物质之间不能通过一步反应实现下图转化的是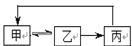
| 甲 |
乙 |
丙 |
|
| A |
AlCl3 |
Al(OH)3 |
Al2O3 |
| B |
SiO2 |
H2SiO3 |
Na2SiO3 |
| C |
Cl2 |
HCl |
NaCl |
| D |
CH2=CH2 |
CH3CH2Cl |
CH3CH2OH |
下列对图象描述正确的是
| A.图①表示体积和pH值均相同的稀硫酸和醋酸,与足量的镁反应生成H2量的关系 |
| B.图②表示向NaOH溶液中滴加稀盐酸,溶液导电性变化的关系 |
C.图③表示2SO2(g)+O2(g) 2SO3(g)反应过程中,SO2和O2反应速率大小关系 2SO3(g)反应过程中,SO2和O2反应速率大小关系 |
| D.图④表示向氨水中滴加稀硫酸时,溶液的pH大小变化关系 |