关于接触法制硫酸的叙述中,不正确的是( )。
| A.从沸腾炉出来的炉气必须净化,主要目的是防止催化剂中毒 |
| B.之所以叫“接触法”是因SO2被氧化成SO3时反应是在催化剂表面进行的 |
| C.黄铁矿粉碎成细小矿粒,在沸腾炉中燃烧快、反应完全,提高了原料的利用率 |
| D.SO3用稀硫酸吸收而不用水吸收,可防止形成酸雾并使SO3吸收完全 |
向较浓盐酸中加入浓硫酸会有白雾产生,下列叙述中与此现象无关的是
| A.浓硫酸具脱水性 | B.浓硫酸具有吸水性 |
| C.盐酸具有挥发性 | D.气态物质的溶解度随温度的升高而降低 |
下列各组离子,在溶液中可以大量共存的是
| A.Na+、S2-、K+、SO32- | B.Na+、SO32-、H+、NO3- |
| C.NH4+、K+、Cl-、OH- | D.H+、K+、ClO-、SiO32- |
相同状况下,在容积相同的三个烧瓶内,分别充满干燥的NH3、HCl与空气1:1的混合气体、NO2气体.然后分别做喷泉实验,实验结束后,烧瓶内3种溶液的物质的量浓度之比为(假设溶质不向外扩散)
| A.3:3:2: | B.1:1:1: | C.2:2:3: | D.无法比较 |
用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验
不合理的是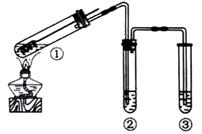
| A.③中选用NaOH溶液吸收多余的SO2 |
| B.上下移动①中铜丝可控制SO2的量 |
| C.②中选用品红溶液验证SO2的生成 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
下表所列各组物质中,不能通过一步反应实现如图所示转化的是
| 物质 选项 |
a |
b |
c |
|
|