在NaCl、MgCl2和MgSO4三种盐配成的混合溶液中,若Na+为0.1 mol,Mg2+为0.25 mol,Cl-为0.2 mol,则SO42-的物质的量为( )。
| A.0.5 mol | B.0.15 mol | C.0.2 mol | D.0.25 mol |
对下列反应①KHCO3溶液与石灰水反应、②Na2SO3溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应。改变反应物用量,不能用同一个离子方程式表示的是( )
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
能正确表示下列反应的离子方程式是( )
| A.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+ 6H+ =2Mn2+ + 5NO3- + 3H2O |
| B.碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3-+2OH-=CO32-+ NH3•H2O +H2O |
| C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I- =2Fe 2+ + I2 |
| D.用惰性电极电解熔融氯化钠: 2Cl—+2H2O=Cl2↑+H2↑+2OH- |
用NA表示阿伏加德罗常数的值。下列叙述正确的是()
A.25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
D.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
下列实验误差分析错误的是
| A.用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
下列说法正确的是
| A.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |
| B.25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)<V(NaOH) |
| C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
D.CH3COOH 溶液加水稀释后,溶液中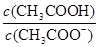 的值减小 的值减小 |