保护环境是每一个公民的责任,下列说法正确的是( )。
| A.大量使用含磷洗涤剂会带来“白色污染” |
| B.减少并逐渐停止生产和使用氟氯代烷的目的是为了减少酸雨 |
| C.废旧电池中的汞、镉、铅等重金属盐不会对土壤和水源造成污染 |
| D.一个现代化的化工企业,应该朝着无废物排出的“封闭式生产”的方向努力 |
已知某反应aA(g) +bB(g)  cC(g) ΔH ="Q" 在密闭容器中进行,在不同温度(T1 和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是
cC(g) ΔH ="Q" 在密闭容器中进行,在不同温度(T1 和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是
A.T1<T2, P1<P2 ,a+b>c ,Q>0
B.T1>T2 ,P1<P2 ,a+b<c ,Q<0
C.T1<T2 ,P1>P2 ,a+b<c, Q>0
D. T1<T2 ,P1>P2 ,a+b>c ,Q<0
已知:H2(g) +I2(g)  2HI(g) ΔH =" -14.9" kJ/mol。在甲、乙两个体积相同密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)="0.008" mol/L。 下列判断正确的
2HI(g) ΔH =" -14.9" kJ/mol。在甲、乙两个体积相同密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)="0.008" mol/L。 下列判断正确的
| 起始浓度 |
c(H2) / mol/L |
c(I2) / mol/L |
c(HI) / mol/L |
| 甲 |
0.01 |
0.01 |
0 |
| 乙 |
0.02 |
0.02 |
0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法不正确的是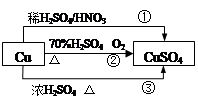
(已知:2Cu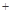 O2
O2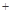 2H2SO4=2CuSO4
2H2SO4=2CuSO4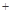 2H2O)
2H2O)
| A.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| B.途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 |
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为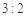 |
D.1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为 |
已知A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2- 和C—,B2+和C—具有相同的电子层结构,下列说法正确的是
A.离子半径:A2->C—>B2+ B.C元素的最高正价一定为+7价
C.对应气态氢化物的稳定性A>CD.还原性:A2-<C-
①在含有FeCl3和BaCl2的酸性混合液中,通入足量SO2气体,有白色沉淀生成,过滤后,向滤液中滴加KSCN溶液,不出现红色,②在氨水和BaCl2的混合液中,通入适量SO2气体,也有白色沉淀生成,由此得出的结论是
| A.白色沉淀都是BaSO3 |
| B.①白色沉淀是BaSO3和S,②是BaSO3 |
| C.①白色沉淀是BaSO4,②是BaSO3 |
| D.①白色沉淀是FeSO3,②是BaSO3 |