根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
①CaBr2+H2O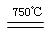 CaO+2HBr
CaO+2HBr
②2HBr+Hg HgBr2+H2↑
HgBr2+H2↑
③HgBr2+CaO HgO+CaBr2
HgO+CaBr2
④2HgO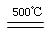 2Hg+O2↑
2Hg+O2↑
该方案的目的是为了制备( )。
| A.HBr | B.CaO | C.H2 | D.Hg |
已知Co2O3在酸性溶液中被还原成Co2+,Co2O3、Cl2、FeCl2、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
| A.3Cl2 +6FeI2 =2FeCl3 +4FeI3 | B.Cl2 +FeI2=FeCl2 +I2 |
| C.Co2O3+6HCl=2CoCl2 +Cl2 +3H2O | D.2Fe3+ +2I— =2Fe2++I2 |
把铁、铜、FeCl3、FeCl2和CuCl2溶液混在一起,铁有剩余,则溶液中所含最多的阳离子是
| A.H+ |
| B.Cu2+ |
| C.Fe3+ |
| D.Fe2+ |
已知:C(s) + O2(g) = CO2 (g);ΔH = -393.5 kJ/ mol;H2(g) +  O2(g) =" 2" H2O(l);ΔH = -241.8 kJ/ mol;
O2(g) =" 2" H2O(l);ΔH = -241.8 kJ/ mol;
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为()
| A.2:3.25 | B.12:3.25 | C.1:1 | D.393.5:241.8 |
| A.Fe粉与硫粉混合加热 |
| B.常温下将氢氧化钡晶体与氯化铵粉末混合反应 |
| C.将铁片投入到稀硝酸溶液中 |
| D.Al粉与NaOH溶液反应 |
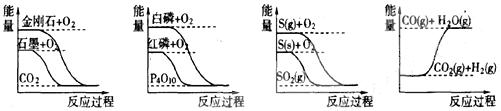
据此判断下列说法中正确的是()
| A.石墨转变为金刚石是吸热反应 |
| B.白磷比红磷稳定 |
| C.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2则△H1>△H2 |
| D.CO(g)+H2O(g)=CO2(g)+ H2 (g);△H1>0 |
解析:由第一个图像可知,石墨具有的能量比金刚石低,,所以A正确;第二个图像可以判断红磷的能量比白磷低,能量越低越稳定,B项错误;第三个图像S蒸气与氧气反应放出的能量更多,而放热为负值,所以C项错误,图4显示D项反应属于放热反应,所以错误。
答案:A