工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: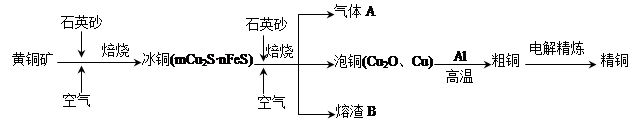
(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
下列反应在210℃时达到平衡:
①PCl5(g) PCl3(g)+Cl2(g); △H1>0 K1=1mol·L—1
PCl3(g)+Cl2(g); △H1>0 K1=1mol·L—1
②CO(g)+Cl2(g) COCl2(g);△H1<0 K2=5×104L·mol—1
COCl2(g);△H1<0 K2=5×104L·mol—1
③COCl2(g) CO(g)+Cl2(g)
CO(g)+Cl2(g)
(1)反应③的平衡常数K3 =。
(2)要使反应①和反应②的K数值相等,可采取的措施是(填序号)。
| A.降低反应①、②体系中Cl2浓度 |
| B.反应①、②选择不同的催化剂 |
| C.反应①、反应②同时升高温度 |
| D.反应①、反应②同时降低温度 |
E.反应①降低温度,反应②维持210℃
(本题3个空,每空2分,共6分)
在盛有100mL浓硝酸的试管中加入32g铜片发生反应。请回答:
(1)开始阶段,反应的离子方程式是。
(2)若二者恰好完全反应,共产生气体11.2L(标准状况)。则浓硝酸的物质的量浓度为。
(3)反应结束后的试管中,再加入金属铜和入少量20%的稀硫酸,这时溶液中又有气泡产生,请写出反应的离子方程式是。
(本题7个空,每空2分,共14分)
(1)9.5g MgCl2溶于水配成100mL溶液,所得溶液的物质的量浓度为,取溶液25.0mL,稀释到500mL,此时溶液中Cl-的物质的量浓度为,在这两个实验中除了用烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是。
(2)在反应3Cl2 + 6KOH(浓) ="=" 5KCl + KClO3 + 3H2O中,氧化产物与还原产物的物质的量之比为,3molCl2参加该反应时,反应中转移mol电子。
(3)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3- +4H++3e- = NO↑+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
①写出该氧化还原反应的化学方程式(不需要配平):。
②反应中硝酸体现了的性质。
(本题9个空,每空2分,共18分)
Ⅰ、碳元素是日常生活中接触非常多的一种元素,回答下列问题。
(1)用化学方程式表示溶洞生成的反应原理:。
(2)可用稀盐酸来鉴别Na2CO3和NaHCO3溶液,现将稀盐酸慢慢滴入碳酸钠溶液中,请写出开始阶段发生反应的离子方程式。
(3)写出用小苏打来治疗胃酸过多时发生反应的离子方程式:。
Ⅱ、氮元素在生命活动中扮演着重要的角色,回答下列与氮及其化合物有关的问题:
(1)德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式表示工业合成氨的反应原理:。写出在氨气的出气口处,检验有氨气生成的操作:。
(2)将氨气通入酚酞溶液中,酚酞溶液变成红色。请用方程式解释原因式:。
Ⅲ、印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜。
(1)写出该反应的离子方程式:;
(2)从使用过的腐蚀液中可以回收金属铜,下列试剂能实现的是(填序号)
| A.氯气 | B.铁 | C.硝酸 | D.稀硫酸 |
(3)向使用过的腐蚀液中通入Cl2,可使Fe2+转化为Fe3+,写出反应的离子方程式。
(16分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。