纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ |
用炭粉在高温条件下还原CuO |
| 方法Ⅱ |
电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: △H >0
△H >0
水蒸气的浓度(mol/L)随时间t(min)变化如下表所示。
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列叙述正确的是 (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化: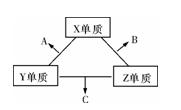
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。
请回答下列问题:
(1)X元素在周期表中的位置是 周期 族。
(2)①C在一定条件下反应生成A的化学方程式是 。
②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 小于 7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式)
。
(3)已知Y单质与Z单质生成C的反应是可逆反应,ΔH<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡后,升高温度,C的体积分数增大
X、Y、Z、W、M五种元素中X、Y、Z、M为短周期主族元素,W是一种常见的金属。
①四种短周期元素中有两种元素在同一主族。
②X的核电荷数比Y少2个。
③五种元素中M的原子序数最小,且核外电子层数和其它元素核外电子层数都不同。
④五种元素中有两种元素可以形成AB型、A2B3型、A3B4型等多种化合物。
⑤X和Y可以形成XY、XY2等化合物。
⑥Z和W可以形成WZ、WZ2等化合物。
请回答:
(1)④中能形成AB型、A2B3型、A3B4型化合物的元素是 。
(2)甲、乙、丙三种常见的可燃气体是由这五种元素中的一种或多种元素组成的。甲、乙、丙燃烧时都发出蓝色或淡蓝色火焰,甲、乙、丙的化学式是 、 、 。
(3)很多反应都可以生成M单质,请再写出两个生成M单质反应的化学方程式。(要求:参加反应的物质由五种元素中的一种或多种元素组成;反应条件不同于实验室制取M单质的反应条件) 、 。
(4)已知WZ2可以在高温条件下和空气中的氧气反应,1mol WZ2充分反应,放出853 kJ的热量。该反应的热化学方程式是 。
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题:
(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请写出NaH的电子式 。
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带 (“正”或“负”)电荷。
(4)下列叙述正确的是 。
| A.h的最高价氧化物对应的水化物是一种强碱 |
| B.硒化氢的稳定性强于f的氢化物的稳定性 |
| C.c的氢化物的水溶液是强酸 |
| D.原子半径:h>e>a |
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2∶1,反应的离子方程式为。
在一定的温度下,对于反应2A(g)+B(g)2C(g)在反应过程中C的物质的量n(C)随着时间变化关系如图所示,现从t1时间开始对反应体系升高温度,n(C)的变化如图所示。试回答下列问题:
(1)p点时反应的v正 v逆(选填“>”、“<”或“=”)。
(2)此反应的正反应为 热反应(填“放”或“吸”)。
(3)a、b两点的正反应速率:va vb(“>”、“<”或“=”)。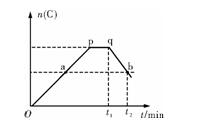
将0.65克Zn粉加入到200ml的足量CuSO4溶液中,锌粉完全溶解,(不考虑反应前后溶液体积的变化)求:
(1)析出铜的物质的量;(2分,写出计算过程)
(2)生成ZnSO4的物质的量及其物质的量浓度;(4分,写出计算过程)
(3)溶液的质量是增加了还是减少了,变化了多少克,说明理由;