X、Y、Z、W均为10电子的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答: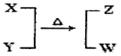
(1)工业上每制取1molZ要放出46.2 kJ的热量,写出该反应的热化学方程式: 。
(2)工业制取Z的化学平衡常数K与T的关系如下表:
| T/K |
298 |
398 |
498 |
…… |
| K/(mol·L—1)—2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②恒温固定体积的容器中,下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内各物质的浓度之比为化学计量数比
B.混合气体密度保持不变
C.容器内压强保持不变
D.混合气体相对分子质量保持不变
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。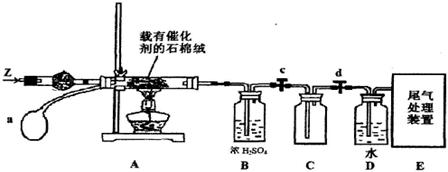
①A中发生反应的化学方程式是 。
②B中浓H2SO4的作用是 。
(4)写出D装置中反应的化学方程式 。
(5)a中通入空气的作用 。
实验室通常用二氧化锰和浓盐酸反应制取氯气写出反应方程式______________,浓盐酸还可以和氯酸钾发生反应制取氯气写出反应方程式______________,氯气具有较强的__________性。
古代的炼金术士们认为通过高温炼制可将某些廉价的金属转化为贵重金属银或金,并在实际操作中得到了貌似黄金的“药金”。操作方法是将炉甘石(含ZnCO3)、赤铜(含Cu2O)和木炭混合加热。已知多数碳酸盐受热分解为两种氧化物。
(1)写出上述制取“药金”过程的有关化学方程式:________________________________________________________________
(2)“药金”的主要成分是_______________,根据现代化学观点,你认为“通过高温炼制可将某些廉价的金属转化为贵重金属银或金”的想法可以实现吗?___________,理由是__________________________________________
(3)现代社会中还不时有人被用“药金”制成的“金元宝”、“金首饰”等欺骗而造成巨大损失,如果是你面对这种情况,如何用较简单的方法来确定它是假的“金元宝”、“金首饰”_______________________________________________________
乙烯、苯是重要的化工原料,请写出下列化学方程式及反应类型。
(1)一定条件下,乙烯与水反应的化学方程式
反应类型为
(2)在适当的温度、压强和有催化剂存在的条件下,乙烯可形成高分子化合物聚乙烯,该反应方程式为
(3)向溴的苯溶液中加入适量的FeBr3_______________________,反应类型_________
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物。
(1)写出下列反应的化学方程式
反应①:
反应②:
反应③:
反应④:
(2)指出下列反应的反应类型:
反应③;反应④.
(1)写出下列官能团的名称:
①—COOH②—OH
(2)现有4种有机物:
①乙烯,②乙醇,③乙酸,④乙酸乙酯(填写结构简式):
②能发生水解反应的是。
③具有酸性且能发生酯化反应的是。
④能发生加成反应的是