将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。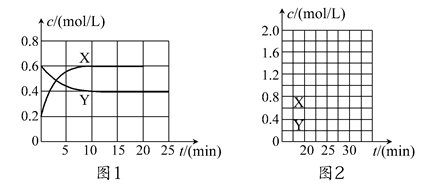
请回答:
(1)图l中,曲线________(填“X”或“Y”)表示NO2浓度随时间的变化情况;前10 min内v(NO2)=________mol/(L·min)。
(2)下列选项中不能说明该反应已达到平衡状态的是________(填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而变化 |
(3)反应进行到10 min时,共吸收热量22.76 kJ,则该反应的热化学方程式为_________________________________;该反应的平衡常数K=________。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为ω1,达到新平衡后混合气体中NO2的体积分数为ω2,则ω1________ω2(填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
(8分)某芳香烃中含碳元素的质量分数为90.6%,相同条件下,其蒸气密度为空气密度的3.66倍(M空气设为29)。
(1)该烃的分子式为__________。其最简单的同系物中能使酸性高锰酸钾溶液褪色的是(写出其结构简式)__________________。
(2)若该烃硝化时,苯环上的一硝基取代物有三种,则该烃的结构简式可能为____________________。
某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为136。
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3。如下图A。
方法三:利用红外光谱仪测得A分子的红外光谱如下图B。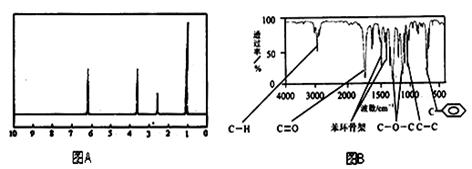
(1)分子中共有种化学环境不同的氢原子;
(2) A的分子式为。
(3) 该物质属于哪一类有机物_____________;
(4)A的分子中只含一个甲基的依据是___________________(填序号)。
a. A的相对分子质量 b. A的分子式
c. A的核磁共振氢谱图 d. A分子的红外光谱图
(5)A的结构简式为。
(6)A的芳香类同分异构体有多种,其中又同时符合下列条件:①能发生水解反应;②分子结构中含有一个甲基。则该类A的同分异构体共有_______种。
化合物A是一种酯,它的分子式为C4H8O2,有下图27转化关系。试回答下列问题。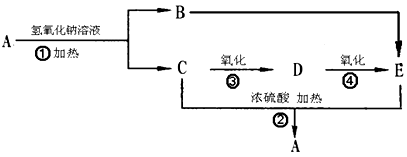
(1)化合物A是。
(2)D中含有的官能团(填名称)。
(3)E的结构简式是。
(4)反应①的反应类型是___________;
(5)反应③的化学方程式为;反应类型是________
(6)写出C 和E生成A的化学方程式。
完成下列反应的化学方程式
(1)苯和溴单质在铁作催化剂下反应:
(2)乙烯与溴的四氯化碳溶液反应:
(3)1-溴丙烷与氢氧化钾的醇溶液共热:
用双线桥法标出下列反应中电子转移的方向和数目:
MnO2 + 4HCl(浓)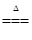 Cl2↑ + MnCl2 + 2H2O
Cl2↑ + MnCl2 + 2H2O
其中,氧化剂是,元素被氧化。