室温下,取0.2 mol·L-1CH3COOH溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是 ( )
| A.混合溶液中由水电离出的c(H+)=10-8 mol·L-1 |
| B.溶液中离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C.混合溶液中c(Na+)=c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1 |
| D.混合溶液中c(OH-)-c(CH3COOH)=c(H+)=1×10-8 mol·L-1 |
阿司匹林又名乙酰水杨酸( 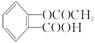 ),它不具有的性质是
),它不具有的性质是
| A.与NaOH溶液反应 |
| B.与金属钠反应 |
| C.与乙酸发生酯化反应 |
| D.与乙醇发生酯化反应 |
关于食品添加剂,下列说法中,正确的是
| A.为了让食品保存得更长一些,可以多加一些添加剂 |
| B.在国家卫生部门规定的范围内使用食品添加剂,一般认为对人体无害 |
| C.染衣服的染料也可以用来给食品染色 |
| D.某腌制的肉类颜色鲜红,说明该食品既新鲜又安全 |
脑白金又名褪黑激素,据报道它具有提高免疫力、促进睡眠等功能。其结构简式为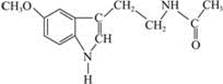
下列有关脑白金的说法不正确的是
| A.能发生加成反应 |
| B.属于芳香族化合物 |
| C.分子式为C14 H16N2O2 |
| D.不能使高锰酸钾酸性溶液褪色 |
“苏丹红一号”实际上一般称为“苏丹一号”,是一种黄溶剂染料,按化学染料分类称为溶剂黄14(c.l.solvent,yellow14),分子式为c 16 h 12 n 2 o,其化学结构属偶氮类染料,是由苯胺重氮化后与2萘酚偶合制得的。有关“苏丹红一号”下列说法正确的是
| A.“苏丹红一号”在食品中能起到增色的作用,可在辣椒酱中用作添加剂 |
| B.“苏丹红一号”的摩尔质量为248 |
| C.“苏丹红一号”可用于溶解剂、机油、蜡和鞋油等产品的染色 |
| D.食品添加剂对人体危害较大,因此应全面禁止使用 |
2009年5月31日 是世界卫生组织发起的第22届世界无烟日。据报道,目前全球有13亿吸烟者,中国就有3.5亿人吸烟,每年有120万人因吸烟而死亡,占全球与吸烟有关疾病死亡人数的1/4。为了你和他人的健康,要远离烟草,养成良好健康的生活习惯。下列有关说法正确的是
| A.香烟烟气中只有尼古丁有毒 |
| B.市售香烟通常装有过滤嘴,所以吸烟对人体无害 |
| C.吸烟只影响自己的健康,不影响他人的健康 |
| D.香烟烟气中的一氧化碳比氧气更容易与血红蛋白结合 |