下列有关σ键和π键的说法错误的是 ( )
| A.含有π键的分子在反应时,π键比σ键易断裂 |
| B.当原子形成分子时,一定形成σ键,可能形成π键 |
| C.有些原子在与其他原子形成分子时,只能形成σ键,不能形成π键 |
| D.在分子中,化学键可能只有π键而没有σ键 |
下列化合物分子,在核磁共振氢谱图中能给出三种信号峰的是
| A.CH3CH2CH3 | B.CH3-O-CH3 |
C. |
D. |
某气态烃1mol能和2molHCl加成,其饱和产物又能和6molCl2发生完全取代。由此可以断定原气态烃是
| A.C2H 6 | B.C2H2 | C.C3H4 | D.C4H6 |
某有机物的结构简式为HCOOCH2CH═CH2,它不具有的官能团是
A.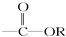 |
B. |
C. |
D.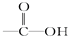 |
有一种滋补品,其有效成分的结构简式如下,下列对该化合物的叙述不正确的是
| A.它属于芳香族化合物 | B.它属于高分子化合物 |
| C.分子式为C13N2H16O2 | D.在一定条件下可以发生加成反应 |
S-诱抗素制剂的分子结构如图,下列关于该分子说法正确的是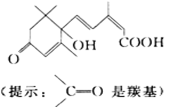
| A.含有碳碳双键、羟基、羰基、羧基 |
| B.含有苯环、羟基、羰基、羧基 |
| C.含有羟基、羰基、羧基、酯基 |
| D.含有碳碳双键、苯环、羟基、羰基 |