(创新预测题)(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
| t/s c/(mol·L-1) |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4)/(mol·L-1) |
0.100 |
a |
0.5b |
0.4b |
|
|
| c(NO2)/(mol·L-1) |
0 |
0.060 |
b |
c1 |
c2 |
c3 |
请回答下列问题:
①表中a=______,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为_________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l) H4SiO4(aq) ΔH
H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:________________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是______________________________________。
(共15分) I写出下列热化学反应方程式
(1)N2 (g)与H2(g)反应生成1molNH3(g),放出46.1KJ热量。
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8KJ热量。
(3)1molC(石墨)与适量H2O(g)反应吸收131.3KJ热量
II .(1)化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因。生成物中化学键形成时会__________能量(填“放出”或“吸收”);如果一个化学反应,化学键断裂时的能量变化大于化学键形成时的能量变化,则该反应属于_________反应;如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。
(2)不同形式的能量可以相互转换,如:化学能和电能、热能之间的相互转换。如图是一个原电池工作原理的示意图。试回答:
①从能量角度看,它属于____________能转化为____________能;
②装置中Zn为____________极。
右图是一个化学过程的示意图。已知甲池的总反应式为:

(1)请回答下列电极的名称:通入CH3OH的电极名称是,
B(石墨)电极的名称是。
(2)写出电极反应式: 通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(3)乙池中反应的化学方程式为。
下图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极。接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g。据此回答问题: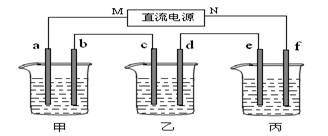
(1)电源的N端为极;
(2)电极b上发生的电极反应为;
(3)电极c上生成的气体在标准状态下的体积:;
(4)甲溶液的氢氧根离子浓度为(设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层铜,则电解质溶液为,e电极的材料是:,f电极的电极反应式为。
工业上制取CuCl2的生产流程如下:
请结合下表数据,回答下列问题:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
⑴ 溶液A中加入NaClO的目的是;
此反应离子方程式为;
⑵ 在溶液B中加入CuO的作用是;
⑶ 操作a的目的是;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是。
25℃、1.01×105Pa时,氢硫酸饱和溶液的浓度为0.1mol·L-1,氢硫酸溶液呈酸性,用方程式表示主要原因。向溶液中加入少量Na2S晶体,振荡后溶液的pH将(填“增大”、“减小”或“不变”)。