为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O电解,Al2O3+3H2↑
电解过程中,以下判断正确的是 ( )。
| |
电池 |
电解池 |
| A |
H+移向Pb电极 |
H+移向Pb电极 |
| B |
每消耗3 mol Pb |
生成2 mol Al2O3 |
| C |
正极:PbO2+4H++2e=Pb2++2H2O- |
阳极:3Al+3H2O-6e- =Al2O3+6H+ |
| D |
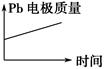 |
 |
【原创】下列物质中既含有非极性共价键又含有离子键的是
| A.MgF2 | B.NaOH | C.H2O2 | D.Na2O2 |
甲、乙是由同主族元素R、Z组成的两种单质,常温下能进行如下反应:甲+ 乙+ H2O —— HRO3 + HZ(未配平)。下列说法正确的是
| A.R原子最外层电子数为5 | B.单质的氧化性:甲>乙 |
| C.原子半径:R>Z | D.HRO3与HZ之计量数比为5:1 |
航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4 N2↑+4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是
N2↑+4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是
| A.反应属于分解反应 |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.反应从能量变化上说,主要是化学能转变为热能和动能 |
| D.在反应中高氯酸铵只起氧化剂作用 |
【改编】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:
A(g)+2B(g) 2C(g)。若经2s 后测得C的浓度为 0.6 mol·L-1 ,现有下列几种说法:① 用物质A表示的反应的平均速率为 0.15 mol·(L·s)-1;② 用物质B表示的反应的平均速率为 0.15mol·(L·s)-1;③ 2s 时物质A的浓度为1.4 mol·L-1;④2s 时物质B的转化率为60% 。其中正确的是
2C(g)。若经2s 后测得C的浓度为 0.6 mol·L-1 ,现有下列几种说法:① 用物质A表示的反应的平均速率为 0.15 mol·(L·s)-1;② 用物质B表示的反应的平均速率为 0.15mol·(L·s)-1;③ 2s 时物质A的浓度为1.4 mol·L-1;④2s 时物质B的转化率为60% 。其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
可以验证硫元素的非金属性比氯元素弱的事实是
①H2S水溶液是弱酸,HCl水溶液是强酸
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铁和铜反应,其产物是FeS、Cu2S、FeCl3、CuCl2
④高氯酸(HClO4)的酸性比硫酸强
| A.①②④ | B.②④ | C.②③④ | D.①②③④ |