太阳能电池可用做电解的电源(如图)。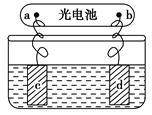
(1)若c、d均为惰性电极,电解质溶液为硫酸铜溶液,电解过程中,c极先无气体产生,后又生成气体,则c极为________极,在电解过程中,溶液的pH________(填“增大”、“减小”或“不变”),停止电解后,为使溶液恢复至原溶液应加入适量的________。
(2)若c、d均为铜电极,电解质溶液为氯化钠溶液,则电解时,溶液中氯离子的物质的量将________(填“增大”、“减小”或“不变”)。
(3)若用石墨、铁作电极材料,可组装成一个简易污水处理装置。其原理是:加入试剂调节污水的pH在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的有色沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。该装置中,阴极的电极反应式为__________________________;阳极区生成的有色沉淀是________。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的电子排布式为________。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为_________。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 。
(5)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 。
(6) ①HClO4、②HIO4、③H5IO6 [可写成(HO)5IO] 的酸性由强到弱的顺序为 (填序号) 。
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右
(图中部分产物未列出):请填写下列空白:
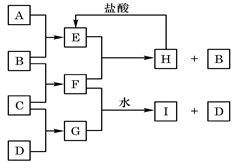 |
(1)A是 ;C是 ;(填写化学式)
F中含有的化学键类型有
(2)H与盐酸反应生成E的离子方程式是 ;
(3)E与F反应的化学方程式是
(4)F与G(物质的量之比为1:1)的水溶液反应生成I和D的离子方程式是: .
现有A、B两种有机化合物,已知:① B分子可以看成A分子中一个氢原子被氨基取代而得到;②它们的分子中氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;③它们都是一取代苯,分子中都不含甲基,都含有一个羧基。
请按要求填空:
(1)A、B的分子中氢元素的质量分数都是;B的分子式为。
(2)A的结构简式是;
(3)C与A互为同分异构体,分子中也没有甲基,但苯环上有两个处于对位的取代基,能发生银镜反应,也能在一定条件下发生消去反应,则C与银氨溶液反应的化学方程式是;
(4)B有一种同分异构体D是某芳香烃发生硝化反应生成的唯一一种一硝基取代物(硝基连在苯环上),则D的结构简式是。
为了测定混有少量KCl杂质的明矾KAl(SO4)2·nH2O的纯度,同时测定 n的值,按下列流程进行实验:
n的值,按下列流程进行实验:
(1)称量样品需用托盘天平,下列有关使用托盘
天平的叙述,不正确的是 ( ).
A、称量前先调节托盘天平的零点
B、称量时左盘放被称量物,右盘放砝码
C、潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D、用托盘天平可以准确称量至0.01克
E、称量完毕,应把砝码放回砝码盒中
(2)判断已脱水至恒重的方法是()
A、长时间加热 B、两次称量的质量必须一样
C、观察有水蒸气不再冒出 D、两次称量的质量差不超过0.1g
(3)在加热结束后,冷却固体的操作为 ;
(4)A溶液是 (填化学式),判断A溶液是否足量的方法是
;
(5)通过实验,测得明矾化学式中n值为12,则明矾的纯度为 %。
(已知KAl(SO4)2·12H2O的式量为474)
氨在国民经济中占有重要地位。请回答有关氨的下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+akJ/mol
4NH3(g)+5O2(g)=4 NO(g)+6H2O(g) △H=-bkJ/mol
NO(g)+6H2O(g) △H=-bkJ/mol
2H2(g)+O2(g)=2H20(g) △H=-ckJ/mol 则N2(g)+3H2(g) 2NH3(g)的△H=;
则N2(g)+3H2(g) 2NH3(g)的△H=;
(2)在一定温度下,将3molN2气体和7molH2气体通入到体积为1L的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是;
①增大压强 ②增大反应物质的浓度
③使用催化剂 ④降低温度
(3)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为;
(4)工业生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水mL(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,两溶液恰好反应,则此盐酸的pH14-a(填“大于”“小于”或“等于”)。