固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是
_______________________________________________________________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):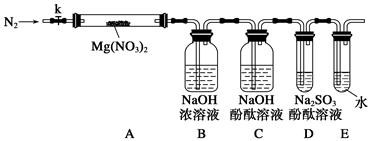
(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明__________。
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是________;关闭k,用酒精灯加热时,正确操作是先________,然后固定在管中固体部位下加热。
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想______是正确的。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:______________(填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是___________________________________________
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加。
Na2SiO3溶液与过量的CO2反应的离子方程式为。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 |
① |
② |
③ |
④ |
| 稀HNO3体积(mL) |
100 |
200 |
300 |
400 |
| 剩余金属质量(g) |
9.0 |
4.8 |
0 |
0 |
| NO体积(L,标况) |
1.12 |
2.24 |
3.36 |
4.48 |
①实验①最先溶解的金属发生反应的化学方程式是。
②滤渣B中Fe的质量分数为____%(精确到0.1%)。
钴(Co)的氧化物是一种重要的化工原料,工业上利用CoCO3+O2→CoxOy+ CO2反应来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。
请填写下列空白:
(1)写出A装置的大试管里发生反应的化学方程式;
(2)E装置的U形管里盛放的物质是;
A.P2O5B.无水CaCl2C.碱石灰D.无水CuSO4
(3)O3的氧化性比O2强。已知制得的O2中含有少量的Cl2和O3,则B装置中所盛放的物质是
A.NaOH溶液 B.饱和NaHCO3溶液 C.饱和NaCI溶液 D.KI溶液
(4)实验结束时,若先撤去A装置中的酒精灯,会引起;
(5)在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为;
(6)此实验装置存在一个比较大的缺陷,如何完善。
某化学兴趣小组利用某废弃的氧化铜锌矿制取活性ZnO实验流程如下:
请回答下列问题:
(1)加入铁粉后发生反应的离子方程式为_________________________________。
(2)甲、乙两同学选用下列仪器,采用不同的方法来制取氨气。
A B
①甲同学使用的药品是熟石灰与氯化铵,则应选用装置_______(填写装置代号),生成氨气的化学方程式为_______________________________________;
②乙同学选用了装置B,则使用的两种药品的名称为_______________。
(3)H2O2的作用是____________________________________________________。
(4)除铁过程中得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂(K2FeO4),该反应中氧化剂与还原剂的物质的量之比为____________。
(5)乙知溶液a中含有CO32-、SO42-两种酸根阴离子,若只允许取用一次样品,检验这种离子存在的实验操作过程为________________________________________________________________________________。
某化学小组用下列装置抽取收集纯净的氯气,并研究其性质。请回稳下列问题。
(1)装置A中发生反应的离子方程式为_______________________________。
(2)按照气流方向各仪器接口的连接顺序为a→___________________→g。
(3)装置B中浓硫酸的作用是__________________________,装置C的试剂最好是___________________________________。
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂。
(5)装制取的氯气通入下图所示装置中,甲装置溶液中具有氧化性的含氯粒子是_______;如何证明乙装置中FeCl2溶液与Cl2发生了反应?(只回答需要的试剂和现象)_。
富马酸亚铁(分子式为C4H2O4Fe,结构简式为 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。
(1)下图为实验室模拟工业制取富马酸亚铁的流程图: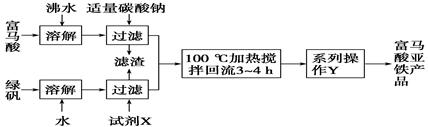
①根据题意,请你写出富马酸的结构简式:________________________。
②绿矾(FeSO4·7H2O)在保存过程中形成的杂质主要有________(填化学式)。
③操作Y包括________、冷却结晶、过滤、洗涤、干燥等。
④判断操作Y中“洗涤”富马酸亚铁产品表明已洗净的实验方法是___________。
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有KSCN溶液、H2O2溶液、稀硫酸。)。填写下表相应空格:
| 步骤 |
实验操作与现象 |
| ① |
取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② |
|
| ③ |