某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 |
锌的状态 |
反应温度/℃ |
收集100 mL氢气 所需时间/s |
| Ⅰ |
薄片 |
15 |
200 |
| Ⅱ |
薄片 |
25 |
90 |
| Ⅲ |
粉末 |
25 |
10 |
(1)该实验的目的是探究________、________对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明________,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是________和________;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:_______________________________________________________________。
2015年巴黎气候变化大会的主题之一是节能减排,开发新能源以及提高能源的利用率再次受到国际社会的高度关注。
(1)近年我国努力调整能源结构,开发新能源。下列物质中,属于可再生能源的是________(填字母)。
A、氢能 B、天然气 C、石油
(2)已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-l
2C(s)+O2(g)=2COg) △H=-221.0 kJ·mol-l
2CO(g)+O2(g)=2CO(g) △H=-556.0 kJ·mol-l
请回答下列问题:
①l g H2(g)在氧气中完全燃烧生成H2O(g)时放出的热量为______________kJ。
氢气被称为绿色能源的主要原因是____________________。
②若18 g C(s)氧气中不完全燃烧,生成的CO(g)与CO2(g)的物质的量之比为2:l,
则该过程放出的热量比等质量的C(s)在氧气中完全燃烧时要少______________kJ。
③将煤转化为水煤气(H2、CO的混合气)是将煤转化为清洁燃料的方法之一。
则C(s)与H2O (g)反应制备水煤气的热化学方程式为__________________________。
(3)工业上可通过CO(g)和H2(g)化合来制备可再生能源CH3OH(g):
CO(g)+2H2(g)=CH3OH(g) △H=-99 kJ·mol-l
又知该反应中某些物质分子里的化学键的键能数据如下表: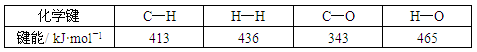
如CO中的C与O之间为叁键连接,则C≡O键的键能为___________kJ·mol-l。
某有机化合物A广泛存在于多种水果中。
(1)经测定,A中仅含有C、H、O三种元素,67 gA在空气中完全燃烧时可生成27g H2O和88 g CO2。则A的实验式或最简式为________________。
若要确定A的分子式,还需要知道A的相对分子质量,测定物质的相对分子质量可以采用___________(填“质谱”或“红外光谱”)法。
经测定A的相对分子质量为134,则A的分子式为_______________。
(2)又知1 molA与足量的NaHCO3溶液充分反应可生成标准状况下的C02气体44.8 L,
l molA与足量的Na反应可生成1.5 mol的H2,则A分子中所含官能团的名称为_________。
(3)若A分子中不存在甲基且有一个手性碳原子,则A的结构简式为________________。
该A在浓硫酸存在下加热,可以生成多种产物,请写出A发生消去反应后所得有机产物的结构简式________________。
(4)A的一种同分异构体B,与A所含官能团的种类和数目均相同,且能催化氧化成醛,则B的1H核磁共振谱图中将会出现__________组特征峰。
合理使用药物是保证身心健康、提高生活质量的有效手段。药物化学已经成为化学的一个重要领域。
(1)我国科学家屠呦呦因发现治疗疟疾的特效药——青蒿素,而获得2015年诺贝尔生理学或医学奖。青蒿素的结构简式如右图所示,其含有的过氧基(—O—O—)具有强氧化性。
请回答下列问题:
①青蒿素的分子式为_______________________。
②下列有关青蒿素的叙述中,正确的是__________(填字母)。
A、青蒿素属于芳香族化合物
B、青蒿素具有强氧化性,可用于杀菌
C、青蒿素分子中的所有碳原子在同一个平面上
D、在一定条件下,青蒿素能与NaOH溶液发生反应
(2)阿司匹林(乙酰水杨酸) 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
请回答下列问题:
①乙酰水杨酸中的含氧官能园的名称为____________________。
②制得的阿司匹林中常含有少量的杂质水杨酸,下列试剂可用于检验阿司匹林样品中是否混有水杨酸的是________________(填字母)。
A、碳酸氢钠溶液 B、三氯化铁溶液 C、石蕊试液
③写出水杨酸与足量的NaHCO3溶液完全反应所得有机产物的结构简式:_____________。
④1 mol乙酰水杨酸与足量的NaOH溶液反应,最多消耗NaOH物质的量为_________mol。
下表给出了ABCDE五种有机物的有关信息
请根据表中信息回答下列问题:
(1)将A通入到少量的溴的四氯化碳溶液中,主要现象是____________________。
(2)B分子的空间构型为___________________。
(3)实验室用C制取少量的A的反应条件为:以浓硫酸作催化剂、温度为_______℃。
(4)C与E发生反应的化学方程式为_______________________________。
(5)D与新制的氢氧化铜的悬浊液反应的化学方程式为___________________________。
(6)E的一种同分异构体F既能在NaOH溶液中发生水解反应,又能与银氨溶液反应,则F的结构简式为______________________。
按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______________。
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
D.溶液中 减小
减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=______________________(溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是____。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_____________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]___________Ksp[Mg(OH)2](填“>”、“=”或“<”)