下表是不同温度下水的离子积的数据:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是_______________________________________________________。
(2)25 ℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)在t2温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a∶b=________。
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
|||||
| 3 |
B |
C |
J |
F |
H |
I |
(1)写出下列元素符号:
B,C,E,
(2)在这些元素中,最活泼的金属元素是,最活泼的非金属元素是。
(3)表中元素,化学性质最不活泼的是,画出其原子结构示意图
只有负价而无正价的是,可用于制半导体材料的元素是_______。
(4)最高价氧化物的水化物碱性最强的是,酸性最强的是,呈两性的是;
(5)A分别与D、E、F、G、H形成的化合物中,最稳定的;
(6)在B、C、D、J、 E、F、G、H中,原子半径最大的是.
在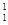 H、
H、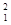 H、
H、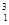 H、
H、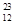 Mg、
Mg、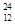 Mg和
Mg和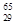 Cu中共有______种元素_______种原子,中子数最多的是________。微粒2311Na+ 中的质子数是___,中子数是_____,核外电子数是____。
Cu中共有______种元素_______种原子,中子数最多的是________。微粒2311Na+ 中的质子数是___,中子数是_____,核外电子数是____。
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。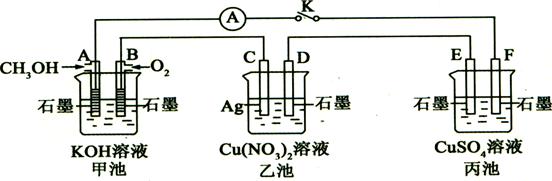
请回答下列问题:
(1)甲池为(填“原电池”、“电解池”或“电镀池”),
A电极的电极反应式为。
(2)丙池中F电极为(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为。
(3)当乙池中C极质量减轻5.4g时,甲池中B电极理论上消耗O2的体积为ml(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是(填选项字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(0H)2CO3 |
如图A 直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为________极;
(2)滤纸B上发生的总化学方程式为___________________;
(3)欲在电槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为________________,电极f上发生的反应为_____________________,
(4) 槽中放的镀液可以是________或________(只要求填两种电解质溶液)。
已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ 能量,根据图中的能量图,回答下列问题: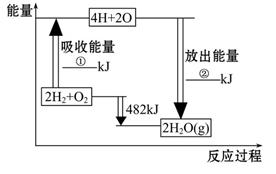
(1)分别写出①②的数值:
①___________KJ;②____________KJ。
(2)生成H2O(g)中的1 mol H—O键放出_____________kJ的能量。
(3)已知:H2O(l)====H2O(g)
ΔH =" +44" kJ·mol-1,试写出2 mol氢气在足量氧气中完全燃烧生成液态水的热化学方程______________________。