人类的生存和发展离不开能源和资源。
(1)家用燃料的更新过程如下:煤→液化石油气或管道煤气→天然气, 下列有关家用燃料更新的理由,正确的是 (选填字母)。
A.天然气属于可再生能源 B.气体燃料比固体燃料利用率更高
C.天然气作为燃料可避免温室效应的发生 D.煤仅仅用作燃料烧掉浪费资源
(2)水是生命之源,合理利用和保护水资源是我们义不容辞的责任。
① 设法除去硬水中的 ,可以使硬水软化成软水。
② 公共场所可利用“活性炭+超滤膜+紫外线”组合工艺获得直饮水,其中活性炭主要起______作用。
(3)海水中有大量可以利用的化学资源,其中所含的氯化镁是金属镁的重要来源之一。从海水中提取金属镁,可按下图流程进行:
①下列有关说法正确的是 (选填字母)。
A.步骤Ⅰ通过一步反应即可实现 B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能 D.在此流程中涉及的基本反应类型有4种
②在此流程中可以循环利用的物质是 。
(4)家中蒸馒头常用的纯碱中含有少量NaCl,某实验小组要测定该纯碱中Na2CO3的质量分数,取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡,此时烧杯中没有不溶物,共消耗稀盐酸72.4g,测得反应后溶液的质量为80g。请帮助实验小组完成以下计算(写出计算过程):
(1)根据质量守恒定律计算生成二氧化碳的质量
(2)样品中碳酸钠的质量分数是多少?
黄铜是铜和锌的合金。向一定质量的黄铜样品中加入154.7g稀硫酸,恰好完全反应,产生0.2g氢气。
(1)求所用稀硫酸的溶质质量分数
(2)除了可求出稀硫酸的溶质质量分数外,你还能求出的化学量有。(填序号)
①锌的质量②铜的质量分数③锌的质量分数④硫酸锌的质量
⑤硫酸溶液的体积⑥反应后溶液溶质质量分数
(5分)为了测定某赤铁矿石中氧化铁的质量分数,取矿石样品40g,加入稀盐酸,恰好完全反应时,共用去稀盐酸219g,过滤、洗涤、干燥后得滤渣8g(矿石中的杂质既不溶于水也不与盐酸反应)。请回答下列问题:
(1)写出反应的化学方程式__________________________________
(2)赤铁矿石中氧化铁的质量分数为_________________________________
(3)列出求解参加反应盐酸质量(x)的比例式________________
(4)向反应后的固液混合物中加入74g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为________________________
(5)欲配制100g上述实验所用的稀盐酸,需要40%的浓盐酸质量为____________________
张南同学想测定赤铁矿中氧化铁的质量分数,做法如下,请回答下列问题。
(1)配制稀硫酸。
①配制200g 19.6%的稀硫酸,需要98%的浓硫酸的体积是;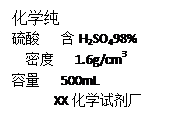
②下图实验过程中出现操作的错误是。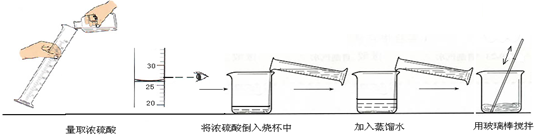
(2)将赤铁矿粉末,用稀硫酸溶解,反应的化学方程式是;
(3)取20g的赤铁矿粉末恰好与l50g的19.6%的稀硫酸完全反应,求解生成硫酸铁质量(x)的比例式为;
(4)此赤铁矿中氧化铁的质量分数为;
(5)向反应后所得溶液中加入34g水,则所得溶液溶质的质量分数是
某同学取氯酸钾和二氧化锰混合物15.5 g,加热至完全反应得到10.7 g固体,问10.7 g固体中有哪些物质,各有多少克?
尿素的化学式为CO(NH2)2,据此请计算:
(1)尿素的相对分子质量为__________。
(2)一袋120 kg的尿素中氢元素的质量是________kg