钢铁是人类生活和生产中非常重要的材料,但全世界每年都有约四分之一的钢铁因生锈损失。某化学课外小组对钢铁制品锈蚀的条件进行了如下探究,设计了如图所示的实验,据此回答下列有关问题:
(1)一周后观察到编号为_________的试管中的铁钉锈蚀严重。
(2)常温下,铁锈蚀是铁跟______和_______(用化学式表示)等物质相互作用的结果。
(3)如何防止家庭中常用的铁制品生锈?简单易行的方法是 (列举一种方法即可)。
利用下图装置进行实验。实验前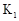 、
、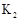 、
、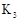 均已关闭。
均已关闭。
| 内容 装置 |
【实验1】制备气体 |
【实验2】测定气体含量 |
 |
Ⅰ.打开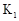 ,用注射器向盛有锌粒的A中注入稀硫酸,直至液面浸没下端导管口 ,用注射器向盛有锌粒的A中注入稀硫酸,直至液面浸没下端导管口Ⅱ.在 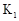 上方导管口收集气体 上方导管口收集气体 |
Ⅰ.A(容积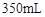 )中为用排空气法收集的 )中为用排空气法收集的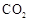 ,B中装满水。用注射器向A中注入15mL NaOH溶液(足量),充分反应 ,B中装满水。用注射器向A中注入15mL NaOH溶液(足量),充分反应Ⅱ.打开 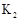 和 和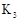 |
(1)检查装置气密性:保持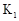 关闭,打开
关闭,打开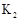 、
、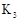 ,向B中加水至液面浸没下端导管口,用手捂住A瓶外壁,说明装置在左侧气密性良好的现象是 ;用同样原理可以检查装置另一侧的气密性。
,向B中加水至液面浸没下端导管口,用手捂住A瓶外壁,说明装置在左侧气密性良好的现象是 ;用同样原理可以检查装置另一侧的气密性。
(2)实验1中,锌与稀硫酸反应的化学方程式为 ;气体收集完毕后,在不拆卸装置的情况下,使A中未反应的稀硫酸大部分转移到B中的操作是 。
(3)实验2中,当B中液面不再变化时,测得B中减少了160mL水,则A中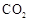 的体积分数约为 %。
的体积分数约为 %。
3%的硼酸溶液可用于清洗皮肤的小面积创伤。现配制300g质量分数为3%的硼酸溶液,实验操作如下:
(1)称量硼酸固体的质量:在下图中分别标出所选砝码的质量和游码的示数。
(2)量取水的体积:用量筒取 mL水( )。
)。
(3)溶解:用到的玻璃仪器是 。
(4)装瓶、贴标签:在右图的标签中填上相应的内容 。
依据下图进行实验(夹持仪器略去)。实验过程:①通入 ,点燃酒精灯,一段时间后,a、b中均无明显现象;②熄灭酒精灯,立即改通
,点燃酒精灯,一段时间后,a、b中均无明显现象;②熄灭酒精灯,立即改通 ,a中无明显现象,b中红磷燃烧。
,a中无明显现象,b中红磷燃烧。
(1)实验过程②中,红磷燃烧的化学方程式为 。
(2)实验过程②中,对比a、b中的实验现象,可知可燃物燃烧的条件之一是 。
(3)实验过程中,能说明可燃物燃烧需要氧气的实验是 。
为绿化环境并改善空气质量,汶上县园林处在县城公路两侧种植了树木。园林工人常在树木上涂刷含有硫黄粉等的石灰浆。这样做的目的是什么? (答一点即可)你还知道氢氧化钙的其它用途吗?
(答两点即可)
化学课外活动中,老师为大家演示了如左下图所示的趣味实验——“魔棒生烟”,该实验原理的微观示意图如右下图所示。
(1)图示反应属于基本反应类型中的 反应。
(2)小丽同学根据实验原理,又设计了如图所示的实验装置。用该装置与用玻璃棒做实验相比,明显的优点是 。
(3)白烟成分NH4Cl中,氮元素的化合价是 。