某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4。其工艺流程如下: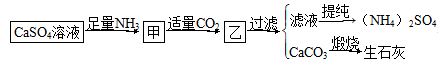
下列推断不合理的是 ( )。
| A.往甲中通CO2有利于(NH4)2SO4生成 |
| B.生成1 mol(NH4)2SO4至少消耗2 mol NH3 |
| C.在实际生产中CO2可被循环使用 |
| D.直接蒸干滤液能得到纯净的(NH4)2SO4 |
下列关于仪器的识别中错误的是



| A.三脚架 | B.蒸发皿 | C.坩埚钳 | D.泥三角 |
下列溶液中Cl-的物质量浓度与50 mL1mol/LAlCl3溶液中Cl—物质的量浓度相等的是
| A.150 mL 2mol/LKCl溶液 | B.75 mL 1 mol/LFeCl3溶液 |
| C.150 mL 1 mol/LMgCl2溶液 | D.75 mL 3 mol/LCuCl2溶液 |
丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55℃,分离水和丙酮时最合理的方法是
| A.蒸发 | B.分液 | C.过滤 | D.蒸馏 |
下列叙述正确的是
| A.1 mol H2O的质量为18g/mol |
| B.CH4的摩尔质量为16g |
| C.3.01×1023个SO2分子质量为32g |
| D.标准状况下,0.5 mol任何物质的体积均约为11.2L |
下列仪器不能加热的是
| A.燃烧匙、蒸发皿 | B.圆底烧瓶、坩埚 |
| C.量筒、容量瓶 | D.试管、锥形瓶 |