认识反应条件对化学反应的影响,对学好化工生产知识具有重要意义。下列说法不正确的是 ( )。
| A.SO2合成SO3虽然属于放热反应,但工业上合成SO3时仍需加热 |
| B.合成氨工业采用高温高压和使用催化剂,因这些条件都符合化学平衡原理 |
| C.合成纯碱的过程中,应首先向饱和食盐水中通入NH3,再通入足量CO2 |
| D.通过加压降温的方法可获得制备NH3的原料气N2 |
下列各物质若n值相等时,其同类的同分异构体最多的是
| A.CnH2n+2O的醇 | B.CnH2nO的醛 | C.CnH2nO2的羧酸 | D.CnH2n+2的烃 |
在下面的电子结构中,第一电离能最小的原子可能是
| A.ns2np3 | B.ns2np5 | C.ns2np4 | D.ns2np6 |
组成为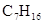 的烷烃有九种,其中仅能由一种单烯烃加氢而制得的有
的烷烃有九种,其中仅能由一种单烯烃加氢而制得的有
| A.1种 | B.2种 | C.3种 | D.4种 |
下列基态原子的电子排布式中,其未成对电子数最多的是
| A.1s22s22p63s23p63d64s2 | B.1s22s22p63s23p64s1 |
| C.1s22s22p63s23p63d54s1 | D.1s22s22p63s23p63d 104s1 |
已知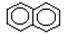 有两种一氯取代物,则
有两种一氯取代物,则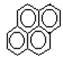 的一氯取代物有
的一氯取代物有
| A.3种 | B.4种 | C.6种 | D.8种 |