实验室用少量的溴水和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: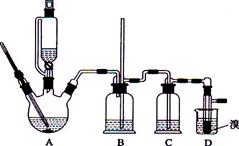
有关数据列表如下:
| |
乙醇 |
1,2-二溴乙烷 |
乙醚 |
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g· cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-l30 |
9 |
-1l6 |
回答下列问题:
(1) 烧瓶A中发生的主要的反应方程式: 。
(2) 安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞。请写出发生堵塞时瓶B中的现象: 。
(3) 在装置C中应加入 (填字母) ,其目的是
a.水 b.浓硫酸 c.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用 洗涤除去。(填字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(5)若产物中有少量副产物乙醚,可用 的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 。
某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片
实验记录(填空,划线部分不必填写):
| 序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
| ① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿 色变为棕黄色 |
Fe2+具有还原性 |
|
| ② |
在FeCl2溶液中加入锌片 |
————— |
Zn+Fe2+=Zn2++Fe |
|
| ③ |
在FeCl3溶液中加入足量铁粉 |
Fe+2Fe3+=3 Fe2+ |
Fe3+具有氧化性 |
|
| ④ |
——————— |
————— |
Fe3+具有氧化性 |
实验结论
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化。
(18分)甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性己检验)。
实验操作和现象:
(1)A中反应的化学方程式是。
(2)C中白色沉淀是,该沉淀的生成表明SO2,具有性。
(3)C中液面上方生成浅棕色气体的化学方程式是。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为
是白雾参与反应。
①为证实各自的观点,在原实验基础上/甲同学在原有操作之前增加一步操作,该操作是
;乙同学在A、B间增加洗气瓶D,D
中盛放的试剂是。
②甲、乙两同学分别改进实验后,B装置中现象分别为:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。请用离子方程式解释甲、乙两同学改进实验后仍然产生沉淀的原因,甲:,乙:。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是。
(3分)下列说法不正确的是。
| A.用100mL的容量瓶准确量取100mL液体 |
| B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| C.用托盘天平称量NaCl时,NaCl放在纸上;称量NaOH时,NaOH放在小烧杯里 |
| D.用加热的方法提取NH4C1固体申湿有的少量碘单质 |
E.浓硝酸与浓盐酸均易挥发,故都必须保存在棕色试剂瓶中,并置于阴凉处
X、Y和W为原子序数依次递增的短周期主族元素,X和Y同主族,且能形成气态化合物YX2。试回答下列问题:
(1)W的原子序数为。
(2)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成、再向该试管中加入(填字母),可以看到白色沉淀生成。
A.氨水 B.稀盐酸 C.硝酸钠 D.氯化钙溶液
(3)某小组设计如图所示的装置图(图中夹持和加热装置略去),研究W2的性质。
①装置A、D中观察到的现象分别为、。
②若装置B中装有5.0 mL l.0×10-3 mol·L-1碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为。
(4)若由元素Y和X组成-2价酸根离子M,M中Y和X的质量比为4:3,已知1mol W2与含1mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生。取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。则W2与含M的溶液反应的离子方程式为。
新型陶瓷氮化铝可用Al2O3高温还原法制备: ,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。
,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。
已知:AIN溶于强碱时会生成NH3。
(1)从原料角度分析,AIN中的杂质可能是,装置A中产生气体的化学方程式为。
(2)装置B中的试剂是____;装置C中长颈漏斗的作用是。
在上图右边的方框中,画出所缺装置图,并注明装置中的试剂。
(3)充分反应后,需打开K1,通入一段时间N2,其目的是。
(4)若样品的质量为mg,实验前后装置C增重ng,则样品中AIN昀纯度为。