现有等体积混合而成的四组气体:①NO2+NO;②NO2+O2;③HCl+N2;④NO+N2,将其分别通入体积相同的试管,并立即倒立于水槽中,试管内水面上升的高度分别为H1,H2,H3,H4,其中高度关系是
| A.H2>H3>H1>H4 | B.H3>H2>H1>H4 |
| C.H1=H2=H3=H4 | D.H1>H2>H3>H4 |
如图,拴上金属条的铁钉插在含有酚酞的NaCl溶液中,可以看到在贴近金属条一边的溶液出现粉红色。该金属条可能是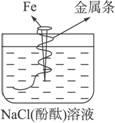
| A.镁 | B.锡 | C.铝 | D.锌 |
下图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 后,使c、d两点短路。下列叙述正确的是
后,使c、d两点短路。下列叙述正确的是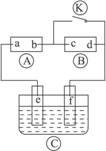
| A.a为直流电源的负极 | B.c极发生的反应为2H++2e-=H2↑ |
| C.f电极为锌板 | D.e极发生还原反应 |
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制得Cl2 0.10 mol,这时电池内消耗的H2SO4的物质的量至少是
| A.0.20 mol | B.0.050 mol | C.0.10 mol | D.0.025 mol |
下列叙述中,正确的是()
①电解池是将化学能转变为电能的装置 ②原电池是将电能转变成化学能的装置 ③金属和石墨导电均为物理变化,电解质溶液导电是化学变化 ④不能自发进行的氧化还原反应,通过电解的原理有可能实现 ⑤电镀过程相当于金属的“迁移”,可视为物理变化
| A.①②③④ | B.③④ | C.③④⑤ | D.④ |
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是()
| A.原混合溶液中c(K+)为2 mol·L-1 |
| B.上述电解过程中共转移2 mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.电解后溶液中c(H+)为2 mol·L-1 |