将一定量的锌与100mL18.5mol/L浓硫酸充分反应,锌完全溶解,同时生成16.8L气体 (标准状况),将反应后的溶液稀释到1L,测得溶液的c(H+)=1mol/L,则下列叙述中错误的是
| A.气体A为二氧化硫和氢气的混合物 |
| B.气体A中二氧化硫和氢气的体积比为4:1 |
| C.反应中共消耗锌95.5g |
| D.反应中共转移电子1.5mol |
下列原子构成的单质中既能与稀硫酸反应又能与烧碱溶液反应,都产生H2的是()
| A.核内无中子的原子 |
| B.价电子构型为3s23p1 |
| C.最外层电子数等于倒数第三层上的电子数的原子 |
| D.N层上无电子,最外层上的电子数等于电子层数的原子 |
下列轨道表示式能表示氧原子的最低能量状态的是( )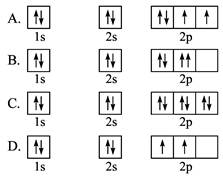
长期以来一直认为氟的含氧酸不存在,自1971年美国科学家用F2通过细冰末获得了次氟酸以来,对HFO的研究才引起重视,下列对HFO中各元素化合价的叙述正确的是()
| A.氢+1价氟+1价氧-2价 | B.氢+1价氟-1价氧0价 |
| C.氢-1价氟+3价氧-2价 | D.氢-1价氟-1价氧+2价 |
A、B、C、D、E五种元素从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下:
| A |
B |
C |
D |
E |
下列说法正确的是()
A.E元素的最高化合价为+7时,D元素的负化合价可为-2
B.A(OH)n为强碱时,B(OH)m也一定为强碱
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质可能有强还原性
M、N两种元素的原子,当它们每个原子获得两个电子形成稀有气体元素原子的电子层结构时,放出的能量M大于N,由此可知()
| A.M的氧化性弱于N | B.M的氧化性强于N |
| C.N2-的还原性弱于M2- | D.N2-的还原性强于M2- |