若NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.22 g乙醛中含有3 NA个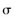 键 键 |
| B.lmol C12与足量Fe完全反应,反应中转移3 N A个电子 |
C.对于Si+O2 SiO2,每当形成2 NA个Si-O键,需断开NA个Si--Si键 SiO2,每当形成2 NA个Si-O键,需断开NA个Si--Si键 |
| D.氯元素的某种核素的质量为ag,该核素的摩尔质量为aNAg/mol |
同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是
| A.原子半径:X>Y>Z |
| B.非金属性:X>Y>Z |
| C.阴离子的还原性按X、Y、Z的顺序由强到弱 |
| D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
根据下列事实:①A+B2+=A2++B;②D+2H2O=D(OH)2↓+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B﹣2e-=B2+.由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是
A.D2+>A2+>B2+>E2+ B.B2+>A2+>D2+>E2+
C.D2+>E2+>A2+>B2+D.E2+>B2+>A2+>D2+
相同状况下,等质量的O2和CO2相比较,下列叙述正确的是
| A.体积比为8︰11 |
| B.分子个数之比为1︰1 |
| C.物质的量之比为11︰8 |
| D.原子个数之比为12︰11 |
下列各组离子,能在溶液中大量共存的是
| A.Fe2+、Ba2+、H+、NO3- | B.Ba2+、Na+、CO32-、 OH- |
| C.K+、Mg2+、SO42-、Cl- | D.H+、 K+、 CO32-、 SO42- |
化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是
| A.化学反应中能量变化的主要原因是化学键的断裂与生成 |
| B.铝热反应中,反应物的总能量比生成物的总能量低 |
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为吸热反应 |