在一定条件下,CO(g)和H2(g)发生反应:CO(g) + 2H2(g)  CH3OH(g) △H=akJ/mol在容积固定的2L密闭容器中充入2mol CO(g)和4molH2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表:
CH3OH(g) △H=akJ/mol在容积固定的2L密闭容器中充入2mol CO(g)和4molH2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表:
下列说法中正确的是
| A.热化学方程式中a>0 |
| B.T1℃下,在第一小时内用H2表示的化学反应速率为0.4mol/(L.h) |
| C.T1℃下,该反应的化学平衡常数为25 |
| D.T2℃下,ɑ1=ɑ2﹥80% |
下列与有机物的结构、性质有关的叙述正确的是( )
| A.苯、油脂均不能使酸性KMnO4溶液褪色 |
| B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 |
| D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 |
下列说法正确的是( )
| A.强电解质溶液一定比弱电解质溶液的导电性强 |
| B.强电解质的水溶液中不存在电解质分子 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.不同的弱电解质只要物质的量浓度相同,电离程度也就相同 |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备——2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备——2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是( )
| A.高铁酸钾与水反应时,水发生氧化反应 |
| B.干法中每生成1mol Na2FeO4共转移4mol电子 |
| C.湿法中每生成1mol Na2FeO4共转移3mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降 |
下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是( )
| A.保持表面干燥 | B.表面镀锌 |
| C.表面镶嵌铜块 | D.与电源负极相连 |
下列变化为放热的化学反应的是 ( ) 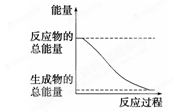
| A.H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1 |
| B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ·mol-1 |
| C.形成化学键时共放出862 kJ能量的化学反应 |
| D.能量变化如右图所示的化学反应 |