随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其主要原因是( )。
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等重金属离子对水和土壤的污染 |
| C.不使电池中渗泄的电解液腐蚀其他物品 |
| D.回收其中石墨电极 |
用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是
| A.c(H+)<c(OH-) | B.c(HCN)<c(CN-) |
| C.c(CN-)+c(OH-) = 0.1mol・L-1 | D.c(HCN)+c(CN-) = 0.2mol・L—1 |
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)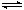 CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如图所示。下列说法错误的是
CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如图所示。下列说法错误的是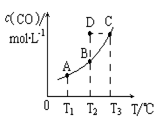
| A.该反应的ΔH>0 |
| B.若T1、T2时的平衡常数分别为K1、K2,则K1=K2 |
| C.通过加热可以使B点变到C点 |
| D.在T2时若反应进行到状态D,则一定有v (正) ﹥v (逆) |
下列分子式所表示的有机物中,其核磁共振氢谱可能只显示一组吸收峰的是
| A.C2H6O | B.C4H9Cl | C.C3H8 | D.C7H8 |
25℃时,水的电离达到平衡:H2O H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是
| A.向水中加入固体CH3COONa,平衡正向移动,c(H+)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)降低,Kw不变 |
| C.向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)=c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-)=2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)