根据以下实验事实,判断选项中四种微粒在酸性条件下,氧化性由强到弱的顺序是( )
(1)向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫红色;
(2)向FeCl2溶液中加入氯水,再加入KSCN溶液,溶液呈红色;
(3)向KMnO4溶液中加入浓盐酸,振荡后紫色褪去。
| A.I2>Cl2>Fe3+>MnO4- |
| B.MnO4->Cl2>Fe3+>I2 |
| C.Cl2>I2>Fe3+,MnO4->Fe3+ |
| D.Fe3+>MnO4->Cl2>I2 |
控制城市空气污染源的方法可以采用( )
| A.使用燃油机 | B.绿化城市 |
| C.出门戴口罩 | D.开发使用太阳能 |
紫杉醇是一种新型抗癌药,其分子式为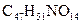 ,它是由如下的A酸和B醇生成的一种酯,A酸结构简式为:
,它是由如下的A酸和B醇生成的一种酯,A酸结构简式为: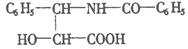 则 B醇的分子式为( )
则 B醇的分子式为( )
A.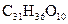 |
B.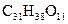 |
C.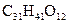 |
D.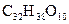 |
在人们的印象中,塑料是常见的绝缘材料,但2000年三名诺贝尔化学奖得主的研究成果表明,塑料经改造后能像金属一样具有导电性,要使塑料聚合物导电,其内部的碳原子之间必须交替地以单键和双键结合(再经掺杂处理).目前导电聚合物已成为物理学家和化学家研究的重要领域.由上述分析,下列聚合物经掺杂处理后可以制成“导电塑料”的是( )
A. |
B. |
C. |
D. |
人的纯净的胃液是一种强酸性液体,pH在0.9~1.5之间,氢氧化铝是一种治疗胃液过多的胃药的主要成分.目前这种胃药已不常用,原因主要是( )
| A.长期摄入铝元素不利于人体健康 |
| B.它不能中和胃液 |
| C.它不易溶于胃液 |
| D.它的疗效太差 |
环境问题关系到人类的生存和发展,保护环境就是保护人类自己.从保护环境的角度出发,目前最有发展前景的一次性餐具是( )
| A.瓷器餐具 | B.塑料餐具 |
| C.淀粉餐具 | D.不锈钢餐具 |