氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,下列说法正确的是( )
| A.由反应可知,氧气、氯气均为氧化产物 |
| B.若化学计量数a=8,则该反应转移电子数为12e- |
| C.若b确定,则方程式中其他物质的化学计量数均能确定 |
| D.若氯酸分解所得混合气体,1 mol混合气体质量为51.5 g,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O |
反应4 (气)+5
(气)+5 (气)
(气) 4NO(气)+6
4NO(气)+6 (气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.54mol,则此反应的平均速率
(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.54mol,则此反应的平均速率 (X)(反应物的消耗速率或产物的生成速率)可表示为 ( )
(X)(反应物的消耗速率或产物的生成速率)可表示为 ( )
A. (NH3)=0.0012mol.L-1.s-1 (NH3)=0.0012mol.L-1.s-1 |
B. (O2)=0.0125mol.L-1.s-1 (O2)=0.0125mol.L-1.s-1 |
C. (NO)=0.0010mol.L-1.s-1 (NO)=0.0010mol.L-1.s-1 |
D. (H2O)=0.054mol.L-1.s-1 (H2O)=0.054mol.L-1.s-1 |
0.02 mol某金属单质与足量的盐酸反应,放出0.672 LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是 ()
| A.第三周期第ⅢA族 | B.第二周期第ⅢA族 |
| C.第三周期第ⅡA族 | D.第四周期第ⅡA族 |
2008年奥运期间,中国提出了“绿色奥运”的口号,下列措施可以提高燃料燃烧效率的是()
(1)提高燃料的着火点 (2)降低燃料的着火点 (3)将固体燃料粉碎
(4)将液体燃料雾化 (5)将煤气化处理 (6)通入适当过量空气
| A.(1)(3)(4)(5) | B.(2)(3)(5)(6) | C.(3)(4)(5)(6) | D.(1)(2)(3)(4) |
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用语的表示方法中错误的是
A.次氯酸的电子式: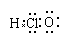 |
B.S2-的结构示意图: |
C.氧—18的原子符号: |
D.CO2分子的结构式:O=C=O |
已知298 K时,2SO2(g)+O2(g)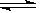 2SO3(g) ΔH="-197" kJ·mol-1。在同一温度和压强下,向某密闭容器中通入2 mol SO4和1 mol O2达到平衡时,反应放出的热量为Q1,向另一相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2。下列关系正确的是()
2SO3(g) ΔH="-197" kJ·mol-1。在同一温度和压强下,向某密闭容器中通入2 mol SO4和1 mol O2达到平衡时,反应放出的热量为Q1,向另一相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2。下列关系正确的是()
A.Q2=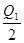 |
B.Q2<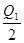 ="197" kJ ="197" kJ |
| C.Q2<Q1<197 kJ | D.Q1=Q2="197" kJ |