材料一 DDT是20世纪60年代以前广为应用的一种杀虫剂,它由三氯乙醛和氯苯通过如下反应制备得到: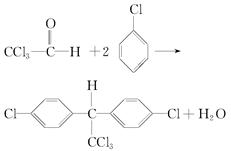
据统计,由于使用了DDT等化学农药,减少了病虫害,挽回的粮食损失占总产量的15%。若以世界粮食产量18亿吨计算,那么有2.7亿吨是由化学农药换回来的,相当于10多亿人一年的口粮。此外,DDT还能有效地杀灭蚊蝇、体虱等传播疾病的害虫,从而大大减少疟疾、伤寒等的发病率和死亡人数。瑞士昆虫学家保罗·米勒因发现DDT药效,而于1948年荣获诺贝尔生理医学奖。
材料二 DDT曾因其稳定性、脂溶性、药效普适性等特点被大量生产和普遍使用,以致造成很大的环境污染。美国生物学家卡尔松曾对包括DDT在内的医药所造成的公害,做过生动的描写:“天空无飞鸟,河中无鱼虾,成群鸡鸭牛羊病倒和死亡,果树开花但不能结果,农夫诉说着莫名其妙的疾病接踵袭来。总之,生机勃勃的田野和农庄变得一片寂静,死亡之幽灵到处游荡……”此发现引起社会强烈反响。从20世纪70年代初起,美国、瑞士等国相继禁止生产DDT。我国政府于1985年禁止使用DDT。
材料三 为了杀灭对人类有害的昆虫,而又避免或减少污染环境和破坏生态平衡。化学工作者进行了不懈地努力,研制出多种新型杀虫剂,以代替DDT等农药。例如,化合物A就是其中一种,其结构简式如图所示。
请完成下列各题。
(1)氯苯是一种重要的化工原料,由氯苯和三氯乙醛生产DDT的反应是__________。
A.化合反应 B.分解反应 C.取代反应 D.加成反应
(2)下列关于DDT的说法中,不正确的是__________。
A.DDT也能杀死有益的生物
B.DDT极易溶于水
C.DDT是烃的衍生物
D.DDT不易被生物分解
(3)在过去,施用农药DDT的地区虽然占陆地面积的一小部分,可是在远离施药地区的南极的动物体内也发现了DDT,在喜马拉雅山山峰的积雪中也发现了DDT,这种现象说明________。
A.DDT是挥发性物质
B.DDT已加入全球性的生物循环
C.考察队将DDT带到了南极
D.南极动物也偶尔到施用农药的地区觅食
(4)①化合物A的分子式为__________;
②化合物A可能有的化学性质________。
A.取代反应 B.加成反应 C.氧化反应 D.还原反应
E.酯化反应 F.水解反应
重铬酸钾(K2Cr2O7)为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程
如下图所示:
已知:①K2Cr2O7有强氧化性
②NaFeO2遇水强烈水解
③Cr2O72-+ H2O  2CrO42- + 2H+
2CrO42- + 2H+
请回答:
(1)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(2)滤液1的成分除NaOH、Na2CrO4外,还含有(填化学式) ;
生成滤渣1中红褐色物质的反应离子方程式是 。
(3)由滤液2转化为Na2Cr2O7溶液应加入的试剂是 。
(4)向Na2Cr2O7溶液中加入K2SO4固体,发生复分解反应而制得K2Cr2O7。生成K2Cr2O7晶体的过程是:加热浓缩、降温结晶、过滤、洗涤、干燥。试简述此法能够制得K2Cr2O7晶体的原因是:;
洗涤时应选用 (选填字母)。
| A.蒸馏水 | B.酒精 | C.稀硫酸 | D.饱和K2SO4溶液 |
(5 )工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72— 转化为Cr3+,该反应的离子方程式为,再调节溶液的pH使金属离子生成沉淀而除去。
A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于短周期的主族金属元素A为 (填元素符号)。
(2)若D是金属单质,D在潮湿的空气中易发生吸氧腐蚀,C溶液在保存时应加入酸和少量D防止其变质,若不加D则C溶液在空气中变质的离子方程式为 ;将D的氯化物的水溶液蒸干并灼烧产物是 。
(3)若A、B、C均为无机化合物,且均含地壳中含量最高的金属元素E,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。
(4)将第(1)题推出的A单质与第(3)题E单质的混合物11.9g投入一定量的水中充分反应,A与E均没有剩余,共收集到标准状况下的气体vL。向所得溶液中逐滴加入浓度为2mol•L-1的H2SO4溶液,至100mL时白色沉淀达到最大量。则v= 。
A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
| 元素 |
相关信息 |
| A |
原子核外有6种不同运动状态的电子 |
| C |
基态原子中s电子总数与p电子总数相等 |
| D |
原子半径在同周期元素中最大 |
| E |
基态原子最外层电子排布式为3s23p1 |
| F |
基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反 |
| G |
基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H |
是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第 周期 族,B元素和C元素的第一电离能比较,较大的是 ,C元素和F元素的电负性比较,较小的是 。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为 ,
B元素所形成的单质分子中σ键与π键数目之比为 。
(3)G元素的低价阳离子的离子结构示意图是_____________,F元素原子的价电子构型的电子排布图(轨道表示式)是__________________,H元素的基态原子核外电子排布式是 。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为 ;
与E元素成对角关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的化学方程式为 。
碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下:
已知①2LiAlSi2O6+H2SO4 Li2SO4+Al2O3·4SiO2•H2O
Li2SO4+Al2O3·4SiO2•H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ 、Ca2+ 、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时沉淀的杂质离子有 ;石灰石调节溶液PH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。
Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置:,其原子核外有种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是(用元素符号表示)。
(2)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,甲的电子式是_______________。
(3)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素可组成多种分子,其空间构型可能是(填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(5)X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应。