某研究小组设计如下工艺路线提纯工业碳酸钠。已知工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42—等杂质。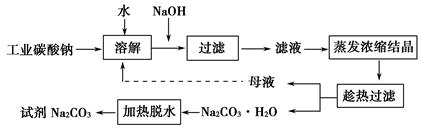
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: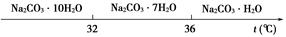
Ⅱ.有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe(OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
根据所给信息,回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为___________________________。
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=__________________________________________
(2)“趁热过滤”时的温度应控制在____________________________________
(3)有人从“绿色化学”的角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行__________________,并说明理由_______________________________________
3分)将铝片和镁片用导线连接后插入NaOH溶液的烧杯中组成原电池,该原电池的负极为___________其电极反应式为 __________________________________________。
下表为元素周期表短周期的一部分请回答下列问题: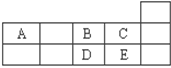
(1)A与B形成的阴离子可能有----------------------------------。(填化学式)
(2)五种元素形成的气态氢化物中最稳定。(填化学式)
(3)写出D的氢化物在过量的B中燃烧的化学方程式___________________________。
(4)写出由A、B两种元素形成的非极性分子的电子式。A、E两元素形成化合物的空间构型为_____________。
A、B、C、D、E、F、G均为有机物,其中A 常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。

|
|

 ,请回答下列问题:
,请回答下列问题:
针对下表中的9种元素,用化学用语回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 1 |
① |
||||||
| 2 |
② |
③ |
④ |
||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)、写出⑧的原子结构示意图:_____________________________
(2)、形成物质种类最多的元素是____________________________
(3)、用电子式表示①和⑨形成化合物的过程____________________________
(4)、⑤⑥⑦最高正价氧化物对应水化物碱性由强至弱的顺序是____________________________
(5)、工业上冶炼⑥的单质选用的方法是 ____________________________
(6)、写出⑦的单质与三氧化二铁反应的化学方程式____________________________
(7)、写出③和⑧的最高正价氧化物对应水化物的浓溶液与一种结构为平面正六边形分子式为C6H6的物质反应的化学方程式:____________________________
下表是元素周期表的一部分,请依据该表回答问题。
| 族 周期 |
IA |
0 |
||||||
| 1 |
H |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
He |
| 2 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
| 3 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
(1)下列说法正确的是
| A.可用于半导体材料的元素是碳 |
| B.PH3的稳定性比H2S强 |
| C.第VA族元素的最高价氧化物对应的水化物化学式均为H3RO4 |
| D.H2SiO3的酸性比H3PO4弱 |
E.NaOH的碱性比Mg(OH)2强
(2)第2周期VIIA族元素的原子结构示意图是_______________,该元素与同周期IA族元素组成的化合物类型是。_______________
(3)第3周期元素的最高价氧化物对应水化物中,酸性最强的是_______________(填化学式,下同);碱性最强的是 _______________;具有两性的是_______________。