在一个体积为1 L的密闭容器中发生某化学反应:2A(g) B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
试回答下列问题:
(1)在实验Ⅰ中,反应在20~40 min内A的平均反应速率为________mol·L-1·min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是________________。
(2)该反应的ΔH________0,其判断理由是________。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L-1 B.0.4 mol·L-1 C.0.7 mol·L-1 D.0.8 mol·L-1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应________。
A.等于86% B.等于50%
C.小于50% D.介于50%~86%之间
制备液晶材料时经常用到有机物Ⅰ,Ⅰ可以用E和H在一定条件下合成:
请根据以下信息完成下列问题:
①A为丁醇且核磁共振氢谱有2种不同化学环境的氢;
②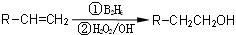
③一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)B按系统命名法名称为:。
(2)芳香族化合物F的分子式为C7H8O, 苯环上的一氯代物只有两种,则F的结构简式为:。
(3)C→D的反应条件为:。
(4)A→B、G→H的反应类型为、。
(5)D生成E的化学方程式为。
E与H反应生成I的方程式为 。
(6)I的同系物K相对分子质量比I小28。K的结构中能同时满足如下条件:①苯环上只有两个取代基;②分子中不含甲基。共有种(不考虑立体异构)。
试写出上述同分异构体中任意一种消耗NaOH最多的有机物结构简式。
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
请回答下列问题:
(1)C原子基态时电子排布式为。
(2)B、C两种元素第一电离能为:>(用元素符号表示)。试解释其因: 。
(3)任写一种与AB_离子互为等电子体的离子。
(4)B与C形成的四原子阴离子的立体构型为,其中B原子的杂化类型是。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式。
(6)D和E形成的化合物的晶胞结构如图,其化学式为,∠EDE= ;E的配位数是;已知晶体的密度为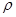 g·cm-3,阿伏加德罗常数为NA,则晶胞边长a=cm.(用
g·cm-3,阿伏加德罗常数为NA,则晶胞边长a=cm.(用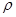 、NA的计算式表示)
、NA的计算式表示)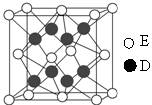
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: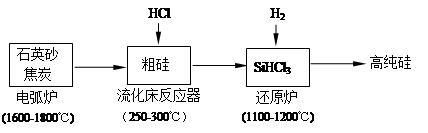
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和;SiHCl3极易水解,其完全水解的产物为。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
(4)还原炉中发生的化学反应为:。
(5)氯碱工业可为上述工艺生产提供部分原料,这些原料是。
下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。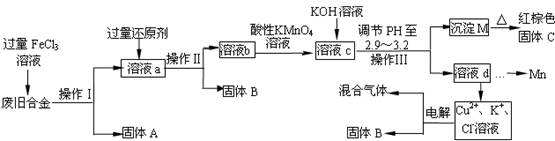
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:。
(3)过量的还原剂应是,溶液b中所含的金属阳离子有。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为。
②若用Xmol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:>>。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Zg,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为L(用含Z的代数式表示)。
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| SO2 |
O2 |
SO2 |
O2 |
|||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
6 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为,表中y=。
②T1T2 ,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与 c(OH-)之比为。
②该溶液中c(OH-)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
③当向该溶液中加入少量NaOH固体时,c(SO32-),c(Na+)。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 。
A.Na2CO3B.Ba(NO3)2 C.Na2S D.酸性KMnO4