室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合后的体积变化)( )
| 序号 |
① |
② |
③ |
④ |
| pH |
12 |
12 |
2 |
2 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
下列事实中,不能用勒夏特列原理解释的是
| A.Fe(SCN)3,溶液中加入固体KSCN后颜色变深 |
| B.向稀盐酸中加入少量蒸馏水,盐酸中氯离子浓度降低 |
| C.实验室常用排饱和食盐水的方法收集氯气 |
| D.棕红色NO2。加压后颜色先变深后变浅 |
现有装有物质的量浓度为1.2 mol/L的盐酸100ml的容器甲和装有物质的量浓度为1mol/L的硫酸100ml的容器乙,向甲.乙容器内加入相同质量的铝,充分反应后生成氢气的体积比为3:4(标准状况下),问所加入的铝的质量是( )
| A.1.08克 | B.1.44克 | C.1.8 克 | D.无法计算 |
下列有关氧化还原反应的叙述正确的是()
| A.物质所含元素化合价降低的反应是还原反应 |
| B.金属原子越容易失去电子,其氧化性越强 |
| C.某元素由化合态转化为游离态,该元素一定被氧化 |
| D.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂 |
如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是()
| X |
Y |
Z |
|
| A |
置换反应 |
氧化还原反应 |
离子反应 |
| B |
铜 |
单质 |
非电解质 |
| C |
石灰水 |
电解质 |
分散系 |
| D |
液氨 |
化合物 |
纯净物 |
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是()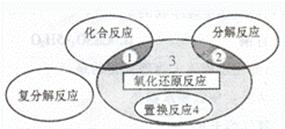
| A.4Fe(OH)2+O2+2H2O =Fe(OH)3 |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
C.4NH3+5O2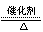 4NO+6H2O 4NO+6H2O |
| D.Zn+H2SO4=ZnSO4 + H2 ↑ |