CrO5的结构式为 ,据此推断该氧化物
,据此推断该氧化物
| A.稳定性比较高,不易分解 |
| B.稳定性比较低,易分解 |
| C.分子中所有原子均达到8电子稳定结构 |
| D.属于碱性氧化物 |
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g)+3D(g) △H<0。如图为该可逆反应的反应速率一时间、转化率一时间关系图,下列分析中不正确的是()
C(g)+3D(g) △H<0。如图为该可逆反应的反应速率一时间、转化率一时间关系图,下列分析中不正确的是()
| A.图甲可体现t0时升高温度对反应速率的影响 |
| B.图乙可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图丙可体现催化剂对化学平衡的影响,且I使用了催化剂 |
| D.图丙可体现温度对化学平衡的影响,且Ⅱ的温度较高 |
下列说法中正确的是()
A. 与 与 均可以水解,故NH4HCO 均可以水解,故NH4HCO 3是弱电解质 3是弱电解质 |
B.25℃时,1LpH=3的盐酸与l LpH=11的氨水 能恰好中和 能恰好中和 |
| C.25℃时,用pH试纸测定出某醋酸溶液的pH=3.5 |
D.25℃时,pH=14的溶液中,Na+、 、K+、ClO-可以大量共存 、K+、ClO-可以大量共存 |
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是()
A.Mg2++ +2Ca2++4OH- +2Ca2++4OH- Mg(OH)2↓+2CaCO3↓+2H2O Mg(OH)2↓+2CaCO3↓+2H2O |
B.Cu2++H2S CuS↓+2H+ CuS↓+2H+ |
C.Zn2++S2-+2H2O Zn(OH)2↓+H2S↑ Zn(OH)2↓+H2S↑ |
D.FeS+2H+ Fe2++H2 S↑ Fe2++H2 S↑ |
下列各项叙述中,正确的是()
| A.电子层序数越大,s原子轨道的半径越大,形状发生明显的变化 |
| B.在同一电子层上运动的电子,其自旋方向肯定不同 |
| C.电负性的大小可以作为判断金属性和非金属性强弱的尺度 |
| D.原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
下列溶液一定能大量共存的离子组是()
A.能与铝反应产生H2的溶液: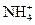 、Na+、Cl-、 、Na+、Cl-、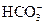 |
| B.含有大量Fe3+的溶液中:Na+、I-、K+、Br- |
C.能使pH试纸变深蓝色的溶液中:Na+、 、S2-、 、S2-、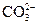 |
D.澄清透明的无色溶液中:ClO-、 、Al3+、 、Al3+、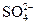 |