反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,由此可判断
C(g)+D(g)过程中的能量变化如图所示,由此可判断
| A.1molA与1molB充分反应后,能量变化为ΔE |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
科学家研制出多种新型杀虫剂代替DDT,化合物A是其中一种。下列关于化合物A的说法正确的是
A.与FeCl3溶液发生反应显紫色 |
B.能发生取代反应和银镜反应 |
C.分子中最多有5个碳原子共平面 |
D.与H2完全加成时的物质的量之比为1∶1 |
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是



| A.将海带灼烧成灰 | B.过滤得含I-溶液 | C.放出碘的苯溶液 | D.分离碘并回收苯 |
利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生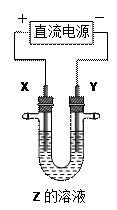
 产。下列说法中正确的是
产。下列说法中正确的是
A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 |
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4  |
C.电镀工业中,X是待镀金属,Y是镀层金属 |
D.外加电流的阴极保护法中,Y是待保护金属 |
下列实验操作能达到目的或对实验结果无影响的是
A.将5.00 mL 12 mol/L的盐酸稀释至500 mL,配制成0.1200 mol/L的盐酸 |
B.酸碱中和滴定前,滴定管用待装液体润洗而锥形瓶没有用待装液体润洗 |
C.向浓氨水中加生石灰,将产生的气体通过碱石灰后得到干燥纯净的氨气 |
D.向FeCl3浓溶液中滴加NaOH溶液,加热至沸腾,制备Fe(OH)3胶体 |
下列反应的离子方程式书写正确的是
A.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑ |
B.氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O  |
C.用小苏打治疗胃酸过多: CO32-+2H+=CO2↑+H2O |
D.硅酸钠溶液中通入过量二氧化碳: SiO32-+CO2+H2O=H2SiO3↓+CO32- |