已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡 常数(25 ℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
由此可得出
A.对应钠盐溶液pH关系为: pH(Na2CO3) > pH(NaCN) > pH(CH3COONa)
B.CO2通入NaCN溶液中有:CO2+H2O+2NaCN→Na2CO3+2HCN
C.冰醋酸中逐滴加水,溶液的导电性、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-) +2c(CO32-)
从某些反应看,NH3和H2O, 和H3O+,
和H3O+,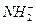 和OH-,N3-和O2-两两类似,据此判断下列反应不正确的是()
和OH-,N3-和O2-两两类似,据此判断下列反应不正确的是()
①2Na+2NH3====2NaNH2+H2↑
②CaO+2NH4Cl====CaCl2+2NH3↑
③3Mg(NH2)2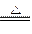 Mg3N2+3NH3↑
Mg3N2+3NH3↑
④NH4Cl+NaNH2====NaCl+2NH3↑
| A.只有③ | B.只有② | C.只有②③ | D.①②③④ |
三氟化氮NF3(与氨分子结构相似)是无色无味的气体,它可由氨和氟直接反应得到:4NH3+3F2====NF3+3NH4F。下列有关NF3的叙述正确的是()
| A.NF3呈三角锥形,是非极性分子 | B.NF3中N是+3价 |
| C.NF3的氧化性比F2强 | D.NF3的还原性比NH3强 |
下列铵盐①NH4F②NH4Cl③NH4Br④NH4I,其热稳定性由强到弱的顺序为( )
| A.④>③>②>① | B.①>②>③>④ |
| C.①>④>③>② | D.无法确定 |
在标准状况下,在三个干燥的烧瓶内分别装入有干燥纯净的NH3、含一半空气的氯化氢气体、NO2和O2的混合气体〔V(NO2)∶V(O2)=4∶17〕。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
| A.2∶1∶2 | B.5∶5∶4 |
| C.1∶1∶1 | D.无法确定 |
用加热方法可分离的一组物质是()
| A.氯化铵和消石灰 | B.碳铵和过氧化钠 |
| C.碘和食盐 | D.硝酸铵和硫酸钠 |