常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图, 根据图示判断,下列说法正确的是
A.H2A在水中的电离方程式是:H2A  H+ + HA-;HA—
H+ + HA-;HA—  H+ + A2-
H+ + A2-
B.当V(NaOH)=20mL时,则有:c(Na+) > c(HA-) > c(H+) > c(A2-) > c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小
D.当V(NaOH)=30mL时,则有:2c(H+) + c(HA-) + 2c(H2A) = c(A2-) + 2 c(OH-)
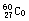 是γ放射源,可用于农作物的诱变育种,我国用该方法培育出了许多农作物新品种。对
是γ放射源,可用于农作物的诱变育种,我国用该方法培育出了许多农作物新品种。对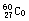 原子的叙述不正确的是
原子的叙述不正确的是
| A.质量数是60 | B.质子数是 60 | C.中子数是33 | D.电子数是27 |
下列物质中,互为同系物的是
| A.O2和O3 |
| B.35Cl和37Cl |
| C.CH3CH3和CH3CH2CH3 |
| D.正戊烷、异戊烷、新戊烷 |
下列分子的电子式书写正确的是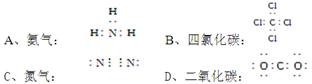
下列微粒结构示意图中,不正确的是
ONa+Cl Cl-
下列关于元素周期律的说法错误的是
| A.同一主族从上至下,元素的原子半径逐渐减小 |
| B.同一周期从左至右,元素的原子半径逐渐减小(稀有气体除外) |
| C.同一周期从左至右,元素金属性逐渐减弱,非金属性逐渐增强。 |
| D.同一主族从上至下,元素金属性逐渐增强,非金属性逐渐减弱 |