利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程。其设计的模拟装置如下:
根据要求填空:
(1)B装置有三种功能:①均匀混合气体;② ;③ 。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应 。
(3)D装置的石棉中均匀混有KI粉末,其作用是 。
(4)E装置的作用是 (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 (填分离方法名称)。
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)。
A.CH4;B.CH3Cl;C.CH2C12;D.CHCl3;E.CCl4
为定性探究乙醇的分子结构,某化学课外小组设计了如下实验方案:在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有医用注射针头的单孔塞,点燃放出的气体,并把一干燥的小烧杯罩在火焰上(如图),在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量的澄清石灰水,观察有无混浊。
(1)以上实验设计存在重大安全隐患,请你帮他们指出来______________________。
(2)确认所用乙醇为无水乙醇的方法是______________________________________。
(3)若向烧杯中加入少量澄清石灰水后发现有混浊,那么燃烧产生CO2的物质最可能是_________________。
(4)若向烧杯中加入少量澄清石灰水后未发现混浊,则可推断乙醇分子结构中含有__________________________________________。
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
(1)指出上述提取碘的过程中有关实验操作的名称和所需主要实验仪器:
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③,步骤⑤。
(2)写出步骤④对应反应的离子方程式:。
(3)步骤④除了加入过量Cl2,下列氧化剂最好选用(填代号)。
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是。
(4)提取碘的过程中,可供选择的有机试剂是。(填编号)
A.酒精 B.醋酸 C.四氯化碳 D.苯
(5)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是。
下列物质的转化或分离是用哪种方法实现的?
| A.溶解 | B.裂解 | C.分馏 | D.裂化 E.干馏 F.蒸馏 |
G.电解 H.过滤 I.萃取
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法)
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)从原油中分离出汽油、煤油、柴油等
(3)将海水淡化;(4)除去粗盐溶液中的泥沙
(5)从海水得到的无水MgCl2中提取金属镁
(6)海水提溴获得的溴水中,提取溴单质。
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下: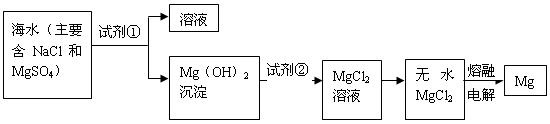
(1)为了使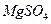 转化为
转化为 ,试剂①可以选用,要使
,试剂①可以选用,要使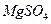 完全转化为沉淀,加入试剂①的量应;
完全转化为沉淀,加入试剂①的量应;
(2)加入试剂①后,能够分离得到 沉淀的方法是;
沉淀的方法是;
(3)试剂②可以选用;
(4)无水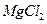 在熔融状态下,通电后会产生
在熔融状态下,通电后会产生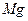 和
和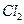 ,该反应的化学方程式为:
,该反应的化学方程式为:
。

 已知某白色混合物粉末中含有 Al2 (SO4)3、Na2SO4、NH4HCO3、NH4Cl、KCl五种物质中的两种。请完成下述探究混合物组成的实验
已知某白色混合物粉末中含有 Al2 (SO4)3、Na2SO4、NH4HCO3、NH4Cl、KCl五种物质中的两种。请完成下述探究混合物组成的实验 限选仪器、用品与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、酒精灯、火柴、试管夹;紫色石蕊试纸;1mol·L-1硝酸、1mol·L-1盐酸、1mol·L-1NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
限选仪器、用品与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、酒精灯、火柴、试管夹;紫色石蕊试纸;1mol·L-1硝酸、1mol·L-1盐酸、1mol·L-1NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。 Ⅰ、初步探究
Ⅰ、初步探究 取适量混合物于烧杯中,用蒸馏水完全溶解,得到无色透明溶液A;取少量A于试管众,滴加稀硝酸,有无色气泡产生,继续滴加稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
取适量混合物于烧杯中,用蒸馏水完全溶解,得到无色透明溶液A;取少量A于试管众,滴加稀硝酸,有无色气泡产生,继续滴加稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。 (1)上述实验证明:该混合物中肯定含有(名称),肯定不含有
(1)上述实验证明:该混合物中肯定含有(名称),肯定不含有 (化学式)
(化学式) Ⅱ、进一步探究
Ⅱ、进一步探究 (2)为了进一步确定该混合固体的组成,需要进行实验1或实验1、2,完成下表:
(2)为了进一步确定该混合固体的组成,需要进行实验1或实验1、2,完成下表:
| 实验操作 |
预期现象和结论 |
实验1:取少量溶液B于试管中,加入少量 Ba(NO3)2溶液,振荡,静置观察。 |
|
实验2: |