(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是 。
(2)已知某粒子的结构示意图为: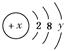 ,试回答:
,试回答:
①当x-y=10时,该粒子为 (填“原子”“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称) 、 、 、 、 。
(1)已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH2,则ΔH1ΔH2
(2)在298K、100kPa时,已知:
2H2(g)+O2(g)==2H2O(g) ΔH1
2HCl(g)==Cl2(g)+H2(g)ΔH2
4HCl(g)+O2(g)==2Cl2(g)+2H2O(g)ΔH3
则ΔH3与ΔH1和ΔH2的关系是:ΔH3=
(3)消除氮氧化物的污染对环境至关重要,用CH4催化还原NOx可以消除氮氧化物的污染。已知一定条件下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则该条件下,用CH4还原NO2至N2的热化学方程式为:
(4)乙烯是石油裂解气的主要成分之一, 25℃、101kPa时,1g乙烯燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为 __;利用该反应设计为燃料电池中,通入乙烯的电极为电池的________(填“正极”或“负极”)。
硫酸生产中,SO2催化氧化生成SO3:2SO2 (g)+O2(g) 2SO3(g) ΔH= —196.6Kj/mol
2SO3(g) ΔH= —196.6Kj/mol
(1)t1℃时,若将2.0mol SO2和1.0mol O2置于10L恒温恒容密闭容器中,8min后反应达到平衡,SO2的平衡转化率为80%,则这段时间内SO3的平均反应速率为,该温度下上述反应的平衡常数K为
(2)该反应达到化学平衡后,以下操作将使平衡正向移动并能提高SO2转化率的是
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气
(3)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n molSO2的同时生成2n molSO3
E.反应体系中SO2、O2、SO3的体积比为2:1:2
(1)请用“>”、“<”或“=”填写下列空格:
①已知:Zn(s)+CuSO4(aq)==ZnSO4(aq)+Cu(s)ΔH="-216" kJ·mol-1,则E反应物E生成物
②由A、B两金属作电极,硫酸溶液作电解质溶液,形成原电池,电流由A极经外电路流向B极,则金属活泼性AB
③镀层破损后铁的腐蚀速度比较:镀锌铁管镀锡铁管
(2)用“增大”、“减小”或“不变”填写下列空格:
④以石墨为电极电解Na2SO4溶液时,电解过程中阳极区溶液的pH
⑤某温度下,可逆反应A(s)+ B(g) 2C(g);△H<0,平衡常数为K。其它条件不变时,温度升高,平衡常数K
2C(g);△H<0,平衡常数为K。其它条件不变时,温度升高,平衡常数K
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题: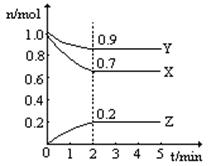
(1)该反应的化学方程式是;
(2)从开始至2min,NH3的平均反应速率是;
(3)用电子式表示X的形成过程___________________ __ __;
(4)第4分钟时下列叙述正确的是;
| A.该反应已停止 | B.该反应为可逆反应 |
| C.3v(H2)=2v(NH3) | D.c(H2):c(N2):c(NH3)=" 7" :9 :2 |
(5)若拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1mol N2与H2反应完全转化为NH3应_________热量(填“吸收”或“放出” )。
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间(秒)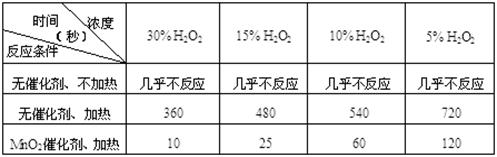
①研究小组在设计方案时,考虑了浓度、、等因素对过氧化氢分解速率的影响。
②上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下: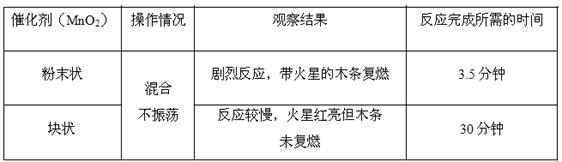
①写出H2O2发生的化学反应方程式。
②实验结果说明催化剂作用的大小与有关。