X、Y、Z、W是短周期的四种元素,有关他们的信息如表所示。
| 元素 |
部分结构知识 |
部分性质 |
| X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
| Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化合价代数和等于6 |
| W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白(不能用字母X、Y、Z、W作答)。
(1)X的气态氢化物分子的电子式是 ,Z元素在周期表中的位置是 。
(2)X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是 。
(3)常温时,W的硫酸盐溶液的pH (填“>”、“<”或“=”)7,理由是: (用离子方程式表示)。
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示) 。
(5)25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式: 。
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的固体产物具有两性。
(1)若稀硝酸腐蚀锌板产生的气体N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式。
(2)在操作①中保持pH=8的目的是。
(3)沉淀I的主要成分是。
(4)操作③中加热、煮沸的目的是;
此步骤操作的理论依据是。
(5)操作④保持pH=2的目的是;
此步骤操作中所用的仪器有带铁圈铁架台、酒精灯、、。
[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 .。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a= 0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。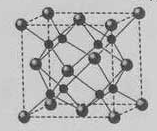
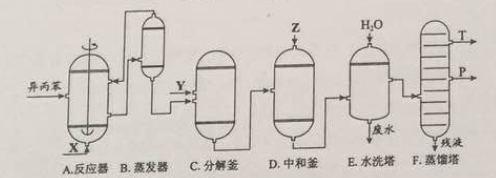
【化学——选修2:化学与技术】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(g/cm-3) |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_______________。
(4)反应②为(填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)
a. NaOH b. CaCO c. NaHCO d. CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
| 化学键 |
H-H |
C-O |
C  O O |
H-O |
C-H |
| E/(kJ.mol-1) |
436 |
343 |
1076 |
465 |
413 |
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是。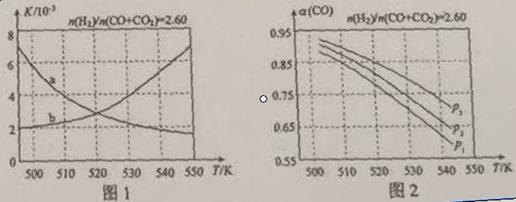
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
[化学---物质结构与性质]
氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是________(用离子方程式表示)。
已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为______________,其中氧原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g)△H=-313kJ·mol-1,F-F键的键能为159kJ·mol-1,Cl-Cl键的键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为______kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。