氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如示意图所示,完成下列填空: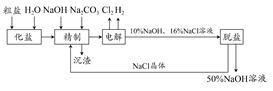
(1)在电解过程中,与电源负极相连的电极上的电极反应式为________________,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是________________________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是________。(选填a、b、c)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_______(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却________、(填写操作名称)除去NaCl。
(1)已知在氨水中存在下列平衡:
①向氨水中加入NaOH固体时,平衡向 (填“正反应”“逆反应”或“不”)移动,OH-的浓度 (填“减小”“增大”或“不变”)
②向氨水中加入浓盐酸,平衡向 (填“正反应”“逆反应”或“不”)移动,此时溶液中浓度增大的离子有NH4+(Cl-除外)和
(2)已知某溶液中只存在OH−、H+、NH4+、Cl−四种离子,某同学推测其离子浓度大小顺序有以下几种:
A.c(Cl−)>c(NH4+)>c(H+)>c(OH−) B.c(Cl−)>c(NH4+)>c(OH−)>c(H+)
C.c(NH4+)>c(Cl−)>c(OH−)>c(H+) D.c(Cl−)>c(H+)>c(NH4+)>c(OH−)
①上述关系一定不正确的是______(填序号).
②若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为______(填序号).
③若四种离子浓度关系有c(NH4+)=c(Cl−),则该溶液显______(填“酸性”、“碱性”或“中性”).
(3)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。
①则:B是______溶液,C是______.
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示.则pHb+pHc= (填某个数)
答案:(1)①逆反应增大 ②正反应 H+(2)促进不变
(3)①B ②A ③中性(4)①CH3COONa盐酸 ②14
亚磷酸(H3PO3)与足量NaOH溶液反应生成Na2HPO3
(1) 亚磷酸是________元酸。
(2)PCl3水解可制取亚磷酸,反应的化学方程式是______________;
(3)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3-
H++H2PO3-
①某温度下,0.10mol•L-1的 H3PO3溶液 pH=1.6,即溶液中 c(H+)=2.5×10-2mol•L-1.求该温度下上述电离平衡的平衡常数K= ________;(只考虑H3PO3的第一步电离,结果保留两位有效数字)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH ______7 (填“>”、“=”或“<”);
(4)亚磷酸具有强还原性,可使碘水褪色.该反应的化学方程式为______________。
现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)_________;
(2)④、⑤、⑥、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)_________;
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是_________;
(4)已知t℃时,Kw=1×10-13,则t℃(填“>”“<”或“=”)_______25℃;在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合液的pH=2,则a:b=____。
CO和NO对环境影响较大,属于当今社会热点问题。请回答下列问题
(1)降低汽车尾气的反应:2NO(g)+2CO(g) N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072 kJ/mol,CO2中C=O的键的键能为750 kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=___________
N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072 kJ/mol,CO2中C=O的键的键能为750 kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=___________
(2)若在一定温度下,将1.4molNO、1.2molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示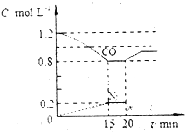
①该反应的平衡常数K=___________
②若保持温度不变,20min时再向容器中冲入CO、N2各0.8mol,平衡将向_______移动(填“向左”“向右”或“不”)
③20min时,若改变反应条件,导致CO浓度发生如图所示的变化,则改变的条件可能 是_______(填序号)
a.缩小容器体积 b.增加CO2的量 c.升高温度 d.加入催化剂
(3)固氮是科学家致力研究的重要课题,自然界中存在天然的大气固氮过程:N2(g)+O2(g)→2NO (g)-180.8kJ,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是______________。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.K越大说明合成氨反应的速率越大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.模拟大气固氮应用于工业上的意义不大
请回答下列问题:
(1)有机物M经过太阳光光照可转化为N,转化过程如下: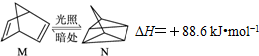
则M、N相比,较稳定的是 _________
(2)25℃条件下,pH=4的盐酸溶液中由水电离出来的H+的浓度为_______mol/L
(3)已知CH3OH的燃烧热△H= -akJ•mol-1,CH3OH(l)+1/2O2(g)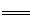 CO2(g)+2H2(g)△H= -bkJ•mol-1,则a_____b(填“>”、“<”或“=”)。
CO2(g)+2H2(g)△H= -bkJ•mol-1,则a_____b(填“>”、“<”或“=”)。
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:_____________________________。