第二周期元素R,它的最外电子层达到稳定结构所需电子数小于最外层达到稳定结构时的电子数和最内层电子数之差,并且等于最内层电子数的整数倍。则关于R的正确说法是( )。
| A.常温下能稳定存在的R的氧化物都能和烧碱溶液起反应 |
| B.R最高价氧化物对应水化物都是强酸 |
| C.R的最简单氢化物可能有两种,其稳定性一种比NH3强,另一种比NH3弱 |
| D.R的最简单氢化物受热时都易分解 |
胡妥油(D)用作香料的原料,它可由A合成得到:
下列说法正确的是( )
A.若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应
B.有机物B既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体
C.有机物C的所有同分异构体中不可能有芳香族化合物存在
D.有机物D分子中所有碳原子一定共面
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期。已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料。则下列推断中正确的是( )
A.A、C两种元素可组成化学式为CA3的化合物
B.F与D形成的化合物性质很不活泼,不与任何酸反应
C.原子半径由大到小的顺序是E>F>C>D
D.元素的非金属性由强到弱的顺序是D>C>F>B
下列图示与对应的叙述相符的是( )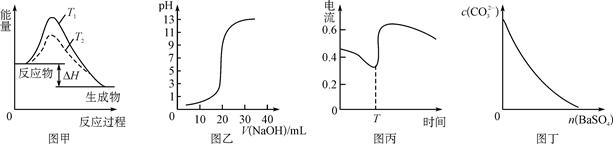
| A.图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 |
| B.图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 |
| C.图丙表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2 |
D.图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO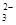 )的浓度变化 )的浓度变化 |
下列离子或分子组中能大量共存且满足相应要求的是( )
| 选项 |
离子 |
要求 |
| A |
K+、AlO 、Cl-、MnO 、Cl-、MnO |
c(K+)<c(Cl-) |
| B |
Fe3+、NO 、I-、HCO 、I-、HCO |
逐滴滴加盐酸立即有气体产生 |
| C |
NH 、Al3+、SO 、Al3+、SO 、CH3COOH 、CH3COOH |
滴加NaOH溶液立刻有气体产生 |
| D |
Na+、Cu2+、Cl-、SO |
逐滴滴加氨水先有沉淀产生,后沉淀消失 |
下列有关离子方程式与所述事实相符且正确的是( )
| A.用惰性电极电解CuCl2溶液:2Cu2++2H2O通电4H++O2↑+2Cu |
B.Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO ===BaSO4↓+2H2O ===BaSO4↓+2H2O |
| C.用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)===Fe(OH)3↓+3H+ |
D.漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO |