可逆反应2SO2+O2 2SO3达到平衡的标志是( )。
2SO3达到平衡的标志是( )。
①消耗2 mol SO2的同时生成2 mol SO3 ②SO2、O2与SO3的物质的量之比为2∶1∶2 ③反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.③ | D.① |
常温下甲为pH=2的醋酸溶液,乙为pH=2的醋酸和盐酸的混合溶液,下列说法正确的是()
| A.甲溶液中c(CH3COO-)一定大于乙溶液中c(CH3COO-) |
| B.甲、乙等体积混合后pH大于2 |
| C.乙溶液离子浓度大小关系为:c(Cl-)>c(CH3COO-)> c(H+)>c(OH-) |
| D.加入相同浓度的NaOH溶液至中性,甲乙两溶液消耗NaOH溶液的体积相同 |
对于平衡体系mA(g)+nB(g) pC(g)+qD(g);ΔH<0。下列结论中正确的是()
pC(g)+qD(g);ΔH<0。下列结论中正确的是()
A.若温度不变,将容器的体积 增大1倍,此时A的浓度变为原来的0.48 倍,则m+n>p+q
增大1倍,此时A的浓度变为原来的0.48 倍,则m+n>p+q
B.若 平衡时,A.B的转化率相等,说明反应开始A.B的物质的量之比为m∶n
平衡时,A.B的转化率相等,说明反应开始A.B的物质的量之比为m∶n
C.若温度.体积不变,当m+n<p+q时,向平衡体系中再加入少量气体E(E与所有组分均不反应),A的转化率减小
D.若升高温度,则反应中逆反应速率减小,正反应速率增大
将等物质的量的X.Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)+2M(s)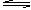 2Z(g);ΔH<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是(
2Z(g);ΔH<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
)
| 选择 |
改变的条件 |
正.逆反应速率变化 |
新平衡和原平衡比较 |
| A |
升高温度 |
逆反应速率增大量大于正反应速率增大量 |
X的体积分数变大 |
| B |
增大压强 |
正反应速率增大,逆反应速率减小 |
Z的浓度不变 |
| C |
减小压强 |
正.逆反应速率都减小 |
Y的体积分数变大 |
| D |
充入一定量Z |
逆反应速率增大 |
X的体积分数变大 |
短周期元素X.Y.Z的原子序数依次递增,其原子的最外层电子数之和为11;Y.
Z在同 一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是()
一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是()
| A.离子半径:Y>X | B.气态氢化物的稳定性:Z>X |
| C.Y的氧化物中含有离子键 | D.Z的氧化物对应的水化物是弱碱 |
下列排列顺序正确的是()
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③沸点:H2Se>H2S>H2O ④结合H+能力:OH->CH3COO->I-
| A.①③ | B.②③ | C.①④ | D.②④ |