50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: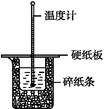
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”)。所求中和热 (填“相等”或“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ,用50 mL 0.50 mol·L-1 NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”或“无影响”)。
为了测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置(铁架台、铁夹等仪器未在图中画出)进行实验: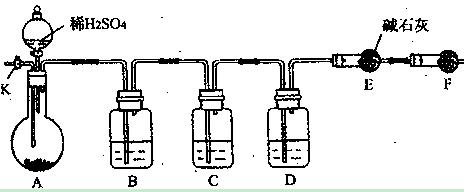
(1)将仪器连接好以后,必须进行的第一步操作是;
(2)装置B的作用是 ;
;
(3)已知装置C中装有品红溶液, 其作用是;
其作用是;
(4)实验室中备有以下常用试剂:a.浓硫酸 b. 品红溶液 c. 酸性高锰酸钾溶液
d. 饱和碳酸氢钠溶液 e. 氢氧化钠溶液 f. 无水硫酸铜 g. 碱石灰
请将下列装置中应盛放的试剂的序号填在横线上:
B中应盛放,D中应盛放,F中应盛放;
(5)若装置E在实验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为。
请按要求分别设计一个简单易行的验证实验。
(1)验证钠和镁的金属性强弱;
(2)验证硫和氯的非金属性强弱。
现在V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,其中V的一种原子的原子核内没有中子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍,Y元素原子最外层电子数是X元素原子最外层电子数的两倍;X、Z是金属元素,Z的核外电子排布与Ar原子相同。请回答:
(1)V是,X是,Z是(填元素符号)
(2)Y在周期表中的位置是;
(3)V和W形成V2W型化合物的电子式为,所含的化学键类型为;
(4)用电子式表示Z和Y形成化合物的过程是。
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素符号:B,C;
(2)画出A2-的离子结构示意图:,
指出D在周期表的位置: ;
;
(3)写出B的呈淡黄色的化合物与CO2反应的化学方程式:;
(4)比较D的气态氢化物与H2S和HF的稳定性:(用化学式表示);
(5)用电子式表示C与D形成化合物的过程:。
已知A是灰黑色的硬而脆的固体,B是气态物质,A~E各种物质的相互转化关系如下图所示。
(1)写出B、D、E三种物质的化学式: B ,D ,E ;
B ,D ,E ;
(2)画出A的原子结构示意图 ;
(3)写出C→A的化学方程式 。