目前已研制成功多种锂电池。某种锂电池的总反应式为Li+MnO2=LiMnO2,下列说法正确的是( )。
| A.Li是正极,电极反应为Li-e-=Li+ |
| B.Li是负极,电极反应为Li-e-=Li+ |
C.Li是负极,电极反应为MnO2+e-=Mn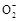 |
| D.Li是负极,电极反应为Li-2e-=Li2+ |
某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①该氯原子的相对原子质量为12 a/b②m g该氯原子的物质的量为m/(aNA) mol
③该氯原子的摩尔质量是aNA g ④a g该氯原子所含的电子为17 mol
| A.①③ | B.②④ | C.①② | D.②③ |
使用Na2CO3·10H2O晶体配制0.1 mol·L-1的Na2CO3溶液,其正确的方法是( )
| A.称取该晶体28.6 g溶于1 L水中 |
| B.称取10.6 g该晶体,溶于水制成1 L溶液 |
| C.将该晶体加热除去结晶水,称取10.6 g溶于水中制成1 L溶液 |
| D.称取该晶体28.6 g溶于水中制成1 L溶液 |
在200 mL某硫酸盐溶液中,含有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
A.2 mol·L-1 B.2.5 mol·L-1C.5 mol·L-1 D.7.5 mol·L-1
下列由相关实验现象所推出的结论正确的是
| A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
根据下列物质的化学性质,判断其应用错误的是()
| A.酒精能使蛋白质变性,可用于杀菌消毒 |
| B.CaO能与SO2反应,可作工业废气的脱硫剂 |
| C.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
| D.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |