将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)  NH3(g) + HI(g) ②2HI(g)
NH3(g) + HI(g) ②2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
达到平衡时,c(H2)=0.5mol/L,c(NH3)=4mol/L,则此温度下反应①的平衡常数为
| A.9 | B.12 | C.16 | D.20 |
下列关于浓硝酸和浓硫酸的叙述正确的是()
| A.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
| B.浓硝酸具有不稳定性,实验室里应保存在棕色瓶中 |
| C.常温下,浓硝酸可以跟铜缓慢反应,浓硫酸可与铜片迅速反应 |
| D.实验室可以用浓硝酸来制氢气 |
下列各组物质属于同素异形体的是( )
| A.16O和18O | B.金刚石、石墨和富勒烯(C60) |
| C.NaCl和KCl | D.H2O和H2O2 |
11.0 g铁铝混合物与足量的盐酸反应,生成标准状况下的氢气8.96 L,则混合物中Fe与Al的物质的量之比()
| A.1:1 | B.1:2 | C.2:1l | D.2:3 |
工业制硫酸中的一步重要反应是SO2在400~500℃下催化氧化,2SO2+O2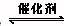 2SO3,这是一个正反应放热的可逆反应。下列有关说法中错误的是()
2SO3,这是一个正反应放热的可逆反应。下列有关说法中错误的是()
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.上述条件下,SO2不可能100%转化为SO3; |
| C.达到平衡状态时,SO2浓度与SO3浓度相等 |
| D.达到平衡状态时,SO2的消耗速率与SO2的生成速率相等 |
关于药品的下列说法中错误的是( )
| A.氢氧化钠、碳酸氢钠、氢氧化铝等能与盐酸反应的物质都可作抗酸药 |
| B.毒品是指由于非医疗目的而反复使用使人产生成瘾性的药品,如吗啡、冰毒等 |
| C.禁止运动员在体育比赛中服用麻黄素 |
| D.用青霉素前使用者一定要进行皮肤敏感试验 |