能正确表示下列化学反应的离子方程式是
| A.饱和石灰水跟稀硝酸反应Ca(OH)2 + 2H+ = Ca2+ + 2H2O |
| B.钠和水反应Na+2H2O=Na++H2↑+2OH- |
| C.大理石与盐酸反应 CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.硫酸与氢氧化钡溶液反应 Ba2++OH-+H++SO42-= BaSO4↓+ H2O |
下列说法正确的是
| A.在一定条件下,乙烯能与H2发生加成反应,苯不能与H2发生加成反应 |
| B.C2H6O和C4H10都有2种同分异构体 |
| C.乙酸乙酯、乙酸均能与NaOH反应,二者分子中官能团相同 |
| D.淀粉和蛋白质均可水解生成葡萄糖 |
组成和结构可用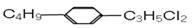 表示的有机物共有(不考虑立体异构体)
表示的有机物共有(不考虑立体异构体)
| A.9种 | B.12种 | C.24种 | D.36种 |
关于下列各实验装置的叙述中,不正确的是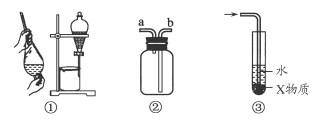
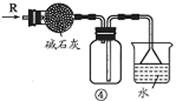
| A.装置①可用于分离C2H5OH和H2O的混合物 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 |
| C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| D.装置④可用于干燥、收集NH3,并吸收多余的NH3 |
在一密闭容器中有CO、H2、O2共16.5g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重7.5g,则原混合气体中O2的质量分数是
| A.54.5% | B.40% | C.36% | D.33.3% |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是
| A.通入22.4 L SO2参加反应时,有2 NA个电子发生转移 |
| B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| C.滴加KI溶液时,KI被氧化,CuI是氧化产物 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |