体积相同的甲、乙两份植物营养液,其所含组分的物质的量浓度如下表:
| |
KCl |
K2SO4 |
ZnCl2 |
ZnSO4 |
| 甲 |
0.3 mol·L-1 |
0.2 mol·L-1 |
0 |
0.1 mol·L-1 |
| 乙 |
0.1 mol·L-1 |
0.3 mol·L-1 |
0.1 mol·L-1 |
0 |
下列对两份营养液成分的分析中,正确的是
A.两种溶液的n(Zn2+)不同
B.两种溶液的c(Cl-)之比为3:1
C.甲溶液的c(K+)="0.5" mol·L-1
D.两种溶液所含的N(SO42-)相等
下列离子方程式正确的是
| A.已知电离平衡常数:H2CO3>HClO>HCO3—,向NaClO溶液中通入少量CO2:2ClO—+CO2+H2O=2HClO+CO32— |
| B.向硫酸氢钠溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++ OH-=BaSO4↓+ H2O |
| C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++ 2I-=2Fe2++ I2 |
D.硫氢根离子的电离方程式:HS-+H2O H3O++S2- H3O++S2- |
仅用下表提供的仪器(夹持仪器和试剂任选),不能实现相应实验目的的是
| 选项 |
实验目的 |
仪器 |
| A |
从食盐水中获得NaCl晶体 |
蒸发皿、玻璃棒、酒精灯 |
| B |
用稀H2SO4、Na2CO3溶液比较元素S与C的非金属性强弱 |
试管、胶头滴管 |
| C |
用8.0mol·L-1的盐酸配制250mL1.5mol·L-1的盐酸 |
250mL容量瓶、玻璃棒、烧杯 |
| D |
测定NaOH溶液的物质的量浓度 |
酸(碱)式滴定管、胶头滴管、锥形瓶、烧杯 |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲 + 乙 = 丁 + 己,甲 + 丙 = 戊 + 己;0.1 mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
| A.1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| B.Y元素在周期表中的位置为第三周期第ⅣA族 |
| C.原子半径:W>Z>Y>X |
| D.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol |
由一种阳离子和两种酸根离子组成的盐称混盐。下列关于混盐Na4S2O3的有关判断,不正确的是
| A.向溶液中加入酚酞溶液变红,说明该混盐水溶液呈碱性 |
| B.向该混盐中加入稀H2SO4可以产生使品红褪色的气体 |
| C.该混盐在酸性条件下可以产生淡黄色浑浊 |
| D.用玻璃棒蘸取该混盐溶液灼烧,火焰呈黄色,说明溶液中含有Na+ |
下表中对应关系正确的是
| 化学方程式 |
结论 |
|
| A |
4CuO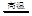 2Cu2O+O2↑ 2Cu2O+O2↑ |
热稳定性:Cu2O>CuO |
| B |
2KClO3+I2 2KIO3+Cl2 2KIO3+Cl2 |
非金属性:I>Cl |
| C |
H2S+CuSO4=CuS↓+H2SO4 |
酸性:H2S>H2SO4 |
| D |
CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH CH3COOH+CH3CH2OH |
反应类型:既是水解反应,也是加成反应 |