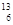 C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关
C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关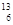 C的说法正确的是( )
C的说法正确的是( )
| A.质子数为6 | B.电子数为13 |
| C.中子数为6 | D.质量数为6 |
下列说法正确的是( )
| A.若把H2S分子写成H3S分子,违背了共价键的饱和性 |
| B.晶体中若有阳离子一定有阴离子 |
| C.金属键存在于任何含金属元素的物质中 |
| D.晶体中一定存在化学键 |
下列分子中的中心原子杂化轨道的类型相同的是( )
| A.CO2与H2O | B.CH4与NH3 | C.BeCl2与BF3 | D.C2H2与C2H4 |
在化学上,常用一条短线表示一个化学键,如下图所示的有关结构中,有直线(包括虚线)不表示化学键或分子间作用力的是( )
| A.石墨的结构 | B.白磷的结构 | C.CCl4的结构 | D.立方烷(C8H8)的结构 |
下列实验操作正确的是()
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯 |
| B.向试管中先加入一定量浓硫酸,再依次加入适量浓硝酸和苯,然后加热制取硝基苯 |
| C.实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 |
| D.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液 |
相对分子质量为100的烃,且含有4个甲基的同分异构体共有(不考虑立体异构)()
| A.3种 | B.4种 | C.5种 | D.6种 |